
chemistry2014for-eng / УМК для инженерных специальностей ЗАОЧНОЕ / Химия для инженерных специальностей
.pdf
3. Первичная диссоциация и структура (состав) комплексного соединения.
К [Аg(СN)2] → К+ + [Аg(СN)2] |
|
внешняя сфера |
внутренняя сфера |
Аg+ – комплексообразователь; СN – монодентатный лиганд. |
|
Один лиганд CN связывается |
с комплексообразователем (Ag+) |
только одной связью, поэтому дентатность этого лиганда равна 1. Количество координационных связей, которыми комплексообразователь связан со всеми лигандами, равно 2, следовательно, координационное число серебра в данном комплексном соединении равно 2.
4. |
Вторичная диссоциация комплексного иона: |
||||
|
[Аg(СN)2] ↔ 2СN + Аg+. |
||||
5. |
Выражение константы нестойкости комплексного иона: |
||||
|
|
Ag |
CN |
2 |
|
|
К нест . |
|
|
||
|
|
|
|
|
|
|
|
|
. |
||
|
|
Ag(CN)2 |
|
|
|
Задание 4. Указать тип гибридизации АО комплексообразователя в ионе [Ag(CN)2] и определить его геометрию, магнитные свойства,
и определить его геометрию, магнитные свойства,
спиновость и окраску раствора.
От ве т . Электронная формула атома – Ag … 4d105s1, а иона – Ag+… 4d105s0. Координационное число равно 2, поэтому донорно-акцепторные связи образуют sp-гибридные орбитали и комплексный ион имеет линейное строение [CN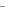 → Ag+ ← CN ] . Внутренние атомные орбитали имеют все спаренные электроны, и комплексный ион диамагнитный.
→ Ag+ ← CN ] . Внутренние атомные орбитали имеют все спаренные электроны, и комплексный ион диамагнитный.
У иона Ag+ d-подуровень заполнен полностью, поэтому комплекс неокрашен.
Вариант 1
1.Определение комплексных соединений, основные положения координационной теории Вернера.
2.Определить степень окисления комплексообразователя: [Fe(СN)6]3 ; [Cu(NH3)4]2+.
3.Получить и охарактеризовать комплексное соединение Na2[NiF4]. (структура, первичная диссоциация, ступенчатая вторичная диссоциация, выражение константы нестойкости суммарной диссоциации комплексного иона).
4.Указать тип гибридизации АО комплексообразователя в ионе
[Ag(CN)2] и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
21

Вариант 2
1.Состав комплексных соединений. Внешняя и внутренняя координационные сферы. Комплексообразователь, лиганды, координационное число.
2.Определить степень окисления комплексообразователя: [Ag(S2O3)2]3 ; [Co(NH3)5Cl]2+.
3.Получить и охарактеризовать комплексное соединение Na2[Zn(OH)4] (структура, первичная диссоциация, ступенчатая вторичная диссоциация, выражение константы нестойкости суммарной диссоциации комплексного иона).
4.Указать тип гибридизации АО комплексообразователя в ионе
[SiF6]2 и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
Вариант 3
1.Классификация комплексных соединений. Катионные, анионные
инейтральные комплексы. Номенклатура комплексных соединений.
2.Определить степень окисления комплексообразователя: [Cr(C2O4)3]3 ; [Cu(SCN)3Cl]2 .
3.Получить и охарактеризовать комплексное соединение Na2[Zn(OH)4] (структура, первичная диссоциация, ступенчатая вторичная диссоциация, выражение константы нестойкости суммарной диссоциации комплексного иона).
4.Указать тип гибридизации АО комплексообразователя в ионе
[Cd(CN)4]2 и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
Вариант 4
1.Типичные комплексообразователи. Факторы, определяющие способность атомов и ионов выступать в роли комплексообразователей. Координационное число комплексообразователя и факторы, определяющие его.
2.Определить степень окисления комплексообразователя: [Ni(CO)4]; [Zn(OH)4]2 .
3.Получить и охарактеризовать комплексное соединение K3[Cr(OH)6] (структура, первичная диссоциация, ступенчатая вторичная диссоциация, выражение константы нестойкости суммарной диссоциации комплексного иона).
22

4. Указать тип гибридизации АО комплексообразователя в ионе [CoF6]3 и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
Вариант 5
1.Типичные лиганды. Молекулы и ионы в качестве лигандов. Факторы, определяющие их способность выступать в роли лигандов. Моно- и полидентатные лиганды.
2.Определить степень окисления комплексообразователя: [NiCl4]2 ; [Fe(NH3)6]3+.
3.Получить и охарактеризовать комплексное соединение Na3[Cr(NO2)6] (структура, первичная диссоциация, ступенчатая вторичная диссоциация, выражение константы нестойкости суммарной диссоциации комплексного иона).
4.Указать тип гибридизации АО комплексообразователя в ионе
[Pt(NH3)2Cl2] и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
Вариант 6
1.Химическая связь в комплексных соединениях: метод валентных связей, теория кристаллического поля.
2.Определить степень окисления комплексообразователя: [Al(OH)4] ; [Cr(NH3)2(H2O)4]3+ .
3.Получить и охарактеризовать комплексное соединение Na2[Pd(NO2)4] (структура, первичная диссоциация, ступенчатая вторичная диссоциация, выражение константы нестойкости суммарной диссоциации комплексного иона).
4.Указать тип гибридизации АО комплексообразователя в ионе
[Mn(SCN)6]2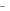 и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
Вариант 7
1.Координационная ненасыщенность атомов и возможность образования комплексных соединений. Природа координационной ненасыщенности. Сочетание электростатического и ковалентного взаимодействия центрального атома (иона) с лигандами.
2.Определить степень окисления комплексообразователя: [Ag(NO2)2] ; [Co(NH3)5Cl]2 .
23

3.Получить и охарактеризовать комплексное соединение [Ni(NH3)4]SO4 (структура, первичная диссоциация, ступенчатая вторичная диссоциация, выражение константы нестойкости суммарной диссоциации комплексного иона).
4.Указать тип гибридизации АО комплексообразователя в ионе
[Co(NO2)6]3 и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
Вариант 8
1.Основные положения теории кристаллического поля. Понятие о высоко- и низкоспиновых комплексах. Спектрохимический ряд лигандов.
2.Определить степень окисления комплексообразователя: [Ag(SO3)2]3 ; [Cu(NH3)4]2+.
3.Получить и охарактеризовать комплексное соединение K2[HgI4] (структура, первичная диссоциация, ступенчатая вторичная диссоциация, выражение константы нестойкости суммарной диссоциации комплексного иона).
4.Указать тип гибридизации АО комплексообразователя в ионе [Cu(En)2]2+ и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
Вариант 9
1.Пространственная конфигурация комплексных ионов. Гибридизация атомных орбиталей комплексообразователя и пространственная конфигурация комплексного иона. Изометрия.
2.Определить степень окисления комплексообразователя: [Ti(H2O)6]3+; [Co(CN)6]3 .
3.Получить и охарактеризовать комплексное соединение K2[SiF4] (структура, первичная диссоциация, ступенчатая вторичная диссоциация, выражение константы нестойкости суммарной диссоциации комплексного иона).
4.Указать тип гибридизации АО комплексообразователя в ионе
[FeF6]3 и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
Вариант 10
1. Устойчивость комплексных соединений в растворах. Константы нестойкости и константы устойчивости. Факторы, определяющие устойчивость комплексных ионов в растворе.
24

2.Определить степень окисления комплексообразователя: [Au(NH3)2]+; [Al(OH)4(H2O)2] .
3.Получить и охарактеризовать комплексное соединение Na2[PtCl6] (структура, первичная диссоциация, ступенчатая вторичная диссоциация, выражение константы нестойкости суммарной диссоциации комплексного иона).
4.Указать тип гибридизации АО комплексообразователя в ионе
[BF4] и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
и определить его геометрию, магнитные свойства, спиновость и окраску раствора.
Тема 4 . ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
Цель: формирование теоретических знаний и понятий в области химической термодинамики, умения на основе законов термодинамики прогнозировать направление протекания процессов.
Задачи: освоить понятия термодинамики: система, параметры, функции; осмыслить законы термодинамики и направление самопроизвольных процессов; описать протекание во времени химических гомогенных и гетерогенных процессов.
Методика выполнения блочно-модульных заданий
Задание 1. Дать ответы на предложенные теоретические вопросы, используя лекционный материал и учебные пособия.
Задание 2.1. Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислить теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са(к) + 0,5О2(г) = СаО(г); ∆Н0 = –635,60 кДж;
Н2(г) + 0,5О2 = Н2О(ж); ∆Н0 = –285,84 кДж; СаО(к) + Н2О(ж) = Са(ОН)2(к); ∆Н0 = –65,06 кДж.
От ве т . Энтальпия (∆Н) – это термодинамическая функция, которая характеризует энергетическое состояние системы при изобарноизотермических условиях (∆Н = Нкон – Ннач). Тепловой эффект (энтальпия ∆Н) химической реакции – это количество теплоты, которое выделяется или поглощается при проведении химических реакций при постоянном давлении и температуре.
Стандартная энтальпия образования сложного вещества (∆Н0) – это энтальпия реакции получения 1 моль этого вещества из простых веществ при стандартных условиях: Р = 1 атм, 101325 Па; Т = 298К (прил. 2).
25

Согласно закону Гесса тепловой эффект (энтальпия) химической реакции зависит только от природы и состояния исходных и конечных веществ, но не зависит от пути перехода, этапов последовательных реакций. Применив закон Гесса, вычислим теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са(к) + 0,5О2(г) = СаО(г); ∆Н0 = –635,60 кДж –
–Н2(г) + 0,5О2 = Н2О(ж); ∆Н0 = –285,84 кДж –
–СаО(к) + Н2О(ж) = Са(ОН)2(к); ∆Н0 = –65,06 кДж Са(к) + 0,5О2(г) + Н2(г) + 0,5О2 (г) + СаО(к) + Н2О(ж) = = СаО(г) + Н2О(ж) + Са(ОН)2(к).
Сократив одинаковые значения, получим уравнение
Са(к) + О2(г) + Н2(г) = Са(ОН)2(к)
и расчет (–635,60 + (–285,84) + (–65,06)) = 986,5 кДж.
Ответ: Са(к) + О2(г) + Н2(г) = Са(ОН)2(к); ∆Н0 = |
986,5 кДж/моль. |
Задание 2.2. Какие из карбонатов: ВеСО3, |
СаСО3 или ВаСО3 |
можно получить при взаимодействии соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделать, вычислив G0298 этих реакций.
От ве т . Зная стандартные значения энергии Гиббса карбонатов, оксидов и СО2, рассчитаем тепловой эффект каждой реакции
G0298(реак) (кДж/моль).
ВеО(т) СаО(т) ВаО(т) СО2(г) ВеСО3(т) СаСО3(т) ВаСО3(т)
582 |
604,2 |
528,4 |
394,38 |
944,7 |
1128,8 |
1139 |
|
|
|
|
ВеО(т) + СО2(г) = ВеСО3(т); |
|
|||
G0298(реак) = ( |
|
944,7) – ( |
582 + ( |
394,38)) = 31,68 кДж. |
|
||
Если ∆G298(реак) > 0, то реакция не может идти самопроизвольно. |
|||||||
G0298(реак) = |
|
ВаО(т) + СО2(г) = ВаСО3(т); |
|
||||
1139 ( 528,4 + ( 394,38)) = |
216,22 кДж. |
|
|||||
Если G0298(реак) < 0, то реакция идет самопроизвольно. |
|
||||||
G0298(реак) = |
|
СаО(т) + СО2(г) = СаСО3(т); |
|
||||
1128,8 – (–604,2 + ( 394,38)) = |
130,22 кДж. |
||||||
Если G0298(реак) < 0, то реакция идет самопроизвольно.
Наиболее энергично идет реакция образования ВаСО3, потому |
|
что имеет наименьшее значение G0298(реак) = |
216,22 кДж. |
Задание 2.3. Определить стандартную теплоту образования (∆Н0)PbO2 |
|
по уравнению PbO2(к) + H2(г) PbO(к) + H2O(г), если ∆Н0298(реак ) = |
|
= 182,8 кДж; ∆Н0 (PbO) = 218 кДж/моль; ∆Н0 (Н2Ог) = 242 кДж/моль. |
|
От ве т . Для данной реакции PbO2(к) + H2(г) |
PbO(к) + H2O(г) из- |
менение энтальпии равно 182,8 кДж; |
|
26 |
|

PbO2(к) + H2(г) PbO(к) + H2O(г); |
Нoреак= 182,8 кДж; |
∆Н0298(реак) = ∆Н0пр. – |
∆Н0исх. |
Н0298(реак) = (∆Н0(PbO) +∆Н0(H2O)) ( ∆Н0(PbO2)+∆Н0(H2))
Подставим известные значения и определим стандартную теплоту образования (∆Н0) PbO2:
182,8 = ( 218 242) – ( Н0(PbO2) + 0);
∆Н0(PbO2) = 277,2 кДж/моль.
От ве т : ∆Н0(PbO2) = 277,2 кДж/моль.
Вариант 1
1. Понятие: система; гомогенные и гетерогенные системы; открытые, закрытые и изолированные системы. Внутренняя энергия системы и энтальпия.
2. На основании расчета изобарно-изотермического потенциала ( G0298(реак)) определить возможность самопроизвольного протекания реакции по схеме:
2N2(г)+4H2O(ж)+O2(г) = 2NH4NO3(к).
G0298(H2O) = 237,5кДж/моль; G0298(NH4NO3) = 183,8 кДж/моль.
Вариант 2
1. Первое начало термодинамики. Тепловой эффект реакции, термохимические уравнения. Экзо- и эндотермические реакции.
2. На основании ∆Н0298 и S0298 соответствующих веществ вычислить G0298(реак) и определить возможность протекания реакции
H4(г) + 3O2(г) = 2CO2(г) + 2H2O(ж).
∆Н0298(кДж/моль) для О2 = 0; C2H4 = 52,28; CO2 = 393,51; H2O(ж) = 285,84; S0298(Дж/(моль К) для O2 = 205,03; C2H4 = 219,4; CO2 = 213,6; H2O(ж) = 69,96.
Вариант 3
1.Закон Гесса и его следствие.
2.При какой температуре наступит равновесие в системе
CO(г) + 2H2(г) CH3OH(ж).
∆Н0298(реак) = 128,05 кДж/моль; S0298(CO) = 197,4 Дж/(моль  К); S0298(H2) = 130,6 Дж/(моль
К); S0298(H2) = 130,6 Дж/(моль  К); S0298(CH3OH) = 126,7 Дж/(моль
К); S0298(CH3OH) = 126,7 Дж/(моль  К).
К).
Вариант 4
1. Направленность химических процессов. Энтропия как мера неупорядоченности системы. Второе начало термодинамики.
27

2. Рассчитайте So298(реак) реакции разложения бертолетовой соли: 2KClO3(к) 2KCl(к) + 3O2(г).
S0(KClO3) = 142,97Дж/(моль  К); S0(KCl) = 82,68Дж/(моль
К); S0(KCl) = 82,68Дж/(моль  К);
К);
S0(O2)=205,03Дж/(моль К).
Вариант 5
1.Энтальпия. Стандартная энтальпия образования и сгорания веществ.
2.При какой температуре наступит равновесие в системе
CH4(г) + CO2(г) 2CO (г) + 2H2(г).
∆Н0298(реак) = +247,37 кДж/моль, если S0298(CH4) = 186,19 Дж/(моль ∙ К); S0298(CO2) = 213,6 Дж/(моль ∙ К); S0298(H2) = 130,6 Дж/(моль ∙ К); S0298(CO) = 197,4 Дж/(моль ∙ К).
Вариант 6
1. Направленность химических процессов. Свободная энергия Гиббса.
2. На основании расчета изобарно-изотермического потенциала ( Go298(реак)) определить возможность самопроизвольного протекания реакции по схеме
2N2(г) + 4H2O(ж) + O2(г) = 2NH4NO3(к).
∆Н0298(H2O) = 285,84кДж/моль; ∆Н0(NH4NO3)= 365,4 кДж/моль и S0298(Дж/(моль ∙ К)) для NH4NO3 = 151,0; N2 = 191,5; O2 = 205,04; H2O = 70,08.
Вариант 7
1.Понятие: система; гомогенные и гетерогенные системы; открытые, закрытые и изолированные системы.
2.Вычислить стандартное изменение энергии Гиббса для химиче-
ской реакции NH3(г) + HCl(г) = NH4Cl(к) по значениям стандартных теплот образования и энтропий веществ, участвующих в реакции.
Вещество.......................... |
NH3 |
HCl |
NH4Cl |
∆Н0298 (кДж/моль).......... |
46,19 |
92,3 |
315,39 |
S0298 (Дж/(моль К))........ |
192,5 |
186,7 |
94,56. |
Вариант 8
1. Стандартная энтальпия образования и сгорания веществ. Закон Гесса и его следствие.
28

2. Определить So298(реак) системы H2(г) + S(к) = H2S.
S0298 (H2) = 130,6 Дж/(моль  К); S0298(S) = 31,88 Дж/(моль
К); S0298(S) = 31,88 Дж/(моль  К);
К);
S0298(H2S) = 205,64 Дж/(моль  К).
К).
Вариант 9
1.Свободная энергия Гиббса. Направления изменений свободной энергии в химических системах.
2.Определите изменение энтропии в стандартных условиях для сле-
дующей химической реакции 2C(графит) + 3H2(г) |
C2H6(г). Энтропии |
веществ, участвующих в реакции: S0298(Дж/ (моль |
К)): C(графит) = 5,74; |
H2(г) = 130,6; C2H6(г) = 229,5. |
|
Вариант 10
1.Энтропия как мера неупорядоченности системы. Второе начало термодинамики.
2.На основании H0298 и S0298 соответствующих веществ вычислить G0298(реак) и определить возможность протекания реакции
C2H4(г) + 3O2(г) = 2CO2(г) + 2H2O(ж).
Значение ∆Н0298(кДж/моль) для C2H4 = 52,28; CO2 = 393,51; H2O(ж) = = 285,84.
Значение S0298(Дж/(моль  К)) для O2 = 205,03; C2H4 = 219,4; CO2 =
К)) для O2 = 205,03; C2H4 = 219,4; CO2 =
=213,6; H2O(ж) = 69,96.
Тема 5 . ХИМИЧЕСКАЯ КИНЕТИКА
Цель: формирование системы теоретических знаний и понятий в области химической кинетики.
Задачи: охарактеризовать сущность и особенности протекания во времени химических гомо- и гетерогенных процессов; объяснить обратимые процессы и принцип Ле-Шателье для химического равновесия; научиться на основе законов кинетики прогнозировать направление протекания процессов.
Методика выполнения блочно-модульных заданий
Задание 1. Дать ответы на предложенные теоретические вопросы, используя лекционный материал и учебные пособия.
29

Задание 2. Записать кинетическое уравнение по закону действующих масс для реакции 2(Н2) + (О2) 2(Н2О). Как изменится скорость реакции, если увеличить давление в 3 раза?
От ве т . По закону действующих масс для данной реакции скорость равна = k[H2]2  [O2].
[O2].
Пусть до изменения условий концентрация [H2] равна а, концентрация [O2] – в моль/л, тогда 1 = k  а2
а2  в.
в.
После увеличения давления в 3 раза концентрация реагирующих веществ также увеличивается в 3 раза: [H2] = 3а; [O2] = 3в.
Тогда 2 = k (3а)2 |
3в; |
2 = 27k а2 в. |
||||
Сравним: |
|
|
27k |
а 2 |
в |
= 27. |
|
|
|
|
|
||
|
|
k |
а 2 |
в |
||
|
|
|
|
|||
Находим, что скорость реакции увеличится в 27 раз.
Задание 3. Записать выражение константы равновесия для реакции
CH4 + H2O CO + 3H2.
В каком направлении будет смещаться равновесие реакции при уменьшении объема?
От ве т . По закону действующих масс для данной реакции скорость
равна = k[СH4]  [Н2О]. Выражение константы равновесия для реакции
[Н2О]. Выражение константы равновесия для реакции
CH4 + H2O CO + 3H2 имеет вид К = [CO] ∙ [H2]3/ ([СH4]  [Н2О]).
[Н2О]).
Реакция идет с увеличением объема (4 > 2), поэтому уменьшение
объема будет смещать равновесие влево. |
|
Задание 4. Равновесие реакции H2 + I2 |
2HI установилось при |
следующих концентрациях: [H2] = 0,5 моль/л, [I2] = 0,1 моль/л, [HI] = =1,8 моль/л. Определить исходные концентрации йода и водорода и константу химического равновесия.
От ве т . Из уравнения реакции следует, |
что к моменту равновесия |
||
израсходовано 0,9 моль/л Н2 и 0,9 моль/л I2: |
|
|
|
0,9 моль |
0,9 моль |
1,8 моль |
|
|
|
|
|
Н |
I |
2HI |
. |
2 |
2 |
|
|
2 моль |
|
||
1моль |
1моль |
|
|
|
|
||
Следовательно, исходная концентрация составляет:
[H2] = 0,5 + 0,9 = 1,4 моль/л; [I2] = 0,1 + 0,9 = 1 моль/л.
Константа химического равновесия равна:
К = |
HI 2 |
1,8 |
2 |
= 64,8. |
||
|
|
|
|
|
||
|
|
|
|
|
||
|
H 2 I 2 |
0,5 |
0,1 |
|||
|
|
30 |
|
|
|
|
