
Бесков - Тестовые задания - 2005 / 2_Phis-chem
.doc2. Физико-химические основы
химико-технологических процессов
2.1. Стехиометрия химических превращений
2.1.1. Стехиометрическое уравнение химического превращения показывает:
-
направление химических превращений;
-
тип химического взаимодействия реагирующих веществ;
-
соотношение количеств веществ, вступающих в химическое взаимо-действие;
-
механизм реакции.
2.1.2. Стехиометрические уравнения химического превращения предназ-начены для:
-
определения выхода продуктов;
-
определения равновесного состава реакционной смеси;
-
установления механизма химической реакции;
-
расчета материального баланса.
2.1.3. Степень превращения х исходного реагента в общем виде определяется по уравнению
1)
х
=
![]() ;
2) х
=
;
2) х
=
![]() ; 3)
х
=
; 3)
х
=
 ;
;
4)
х
=
![]() ;
5) х
=
;
5) х
=
![]() .
.
2.1.4. Пределы изменения степени превращения х реагента в простой обратимой химической реакции:
-
0 ≤ х ≤1;
-
0 ≤ х ≤ хравн;
-
1 < х < 0;
-
1 ≤ х ≤ 0.
2.1.5. Предел изменения степени превращения х реагента в простой необратимой химической реакции:
-
0 ≤ х ≤1;
-
0 ≤ х ≤ хравн;
-
1 < х < 0;
-
хравн < х j ≤ 0;
-
0 х 0.
2.1.6. Селективность процесса есть отношение:
-
количества целевого продукта к количеству побочных продуктов;
-
количества целевого продукта к количеству всего превращенного исходного вещества;
-
количества исходного вещества, превратившегося в целевой продукт, к количеству всего превращенного исходного вещества;
-
количества целевого продукта к количеству всех продуктов (целевого и побочных);
2.1.7. Для расчета сложной реакции необходимо учитывать:
-
все протекающие реакции;
-
только линейно независимые реакции;
-
только целевую реакцию;
-
целевую и одну принципиальную конкурирующую реакции;
-
любые стехиометрическн независимые уравнения.
2.2. Термодинамика химических превращений
2.2.1. Как оценить вероятность самопроизвольного протекания химического процесса?
-
по виду кинетического уравнения;
-
по величине ΔH:
ΔH > 0, протекание реакции вероятно,
ΔH < 0 – невероятно;
-
по величине ΔG:
ΔG > 0, протекание реакции вероятно,
ΔG < 0 – невероятно;
-
по величине ΔG:
ΔG > 0, протекание реакции невероятно,
ΔG < 0 – вероятно;
-
используя принцип Ле-Шателье;
-
вероятность зависит от скорости протекания химического процесса.
2.2.2. Возможно ли реализовать самопроизвольное протекание химического превращения?
-
нет;
-
возможно при использовании катализатора;
-
возможно за счет изменения аппаратурного оформления химического реактора или изменения гидродинамической модели;
-
в некоторых случаях возможно за счет увеличения температуры проведения процесса;
2.2.3. Что определяет величину константы равновесия?
-
отношение константы скорости реакции в прямом направлении к константе скорости в обратном направлении;
-
логарифм отношения произведения парциальных давлений продуктов реакции к произведению парциальных давлений исходных реагентов;
-
отношение константы скорости обратной реакции к константе скорости прямой реакции;
-
отношение произведения концентраций продуктов реакции к произведению концентраций исходных реагентов со стехиометрическими коэффициентами в показателях степеней концентраций.
2.2.4. Определите условия эффективного проведения равновесного химического процесса:
-
при максимально возможном приближении к условиям равновесия;
-
в точке равновесия, где достигается максимальный выход продукта;
-
при максимальной движущей силе, т.е. вдали от условий равновесия;
-
при понижении температуры для экзотермического процесса и максимальной температуре для эндотермического процесса;
-
при максимальной температуре для любого обратимого процесса;
-
при понижении температуры для эндотермического процесса и максимальной температуре для экзотермического процесса;
2.2.5. При понижении температуры и повышении давления равновесие экзотермической реакции N2 + 3H2 2NH3 – H сдвигается:
-
вправо;
-
влево;
-
не сдвигается.
2.2.6. Как изменяется равновесная степень превращения исходных веществ в обратимом экзотермическом процессе?

2.2.7. Как изменяется равновесная степень превращения исходных веществ в обратимом эндотермическом процессе?

2.2.8. Константа равновесия Кр для гетерогенной реакции обжига известняка СаСО3(тв) = СаО(тв) + СО2(г) выражается через парциальные давления компонентов уравнением:
1)
Кр
=
 ; 2)
Кр
=
; 2)
Кр
=
![]() ; 3)
Кр
=
; 3)
Кр
=
![]() ;
;
4)
Кр
=
![]() ; 5)
Кр
=
; 5)
Кр
=
![]() ;
;
2.2.9. Константа равновесия Кр для гетерогенной реакции
FeO(тв) + H2(г) = Fe(тв)+ H2О(г)
выражается через парциальные давления компонентов уравнением:
1)
Кр
=
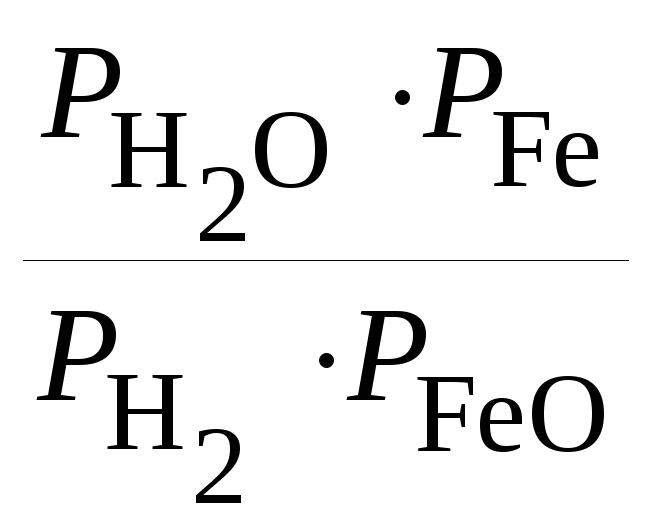 ; 2)
Кр
=
; 2)
Кр
=
 ; 3)
Кр
=
; 3)
Кр
=
![]() ;
;
4)
Кр
=
![]() ; 5)
Кр
=
; 5)
Кр
=

2.2.10. Как увеличить равновесную степень превращения диоксида серы в реакции окисления 2SO2 + O2 = 2SO3 – H?
-
увеличением температуры;
-
уменьшением температуры;
-
увеличением давления;
-
уменьшением давления;
-
увеличением начальной концентрации SO2 по отношению к концентрации O2.
2.2.11. Как увеличить равновесную степень превращения в реакции дегидрирования бутана?
-
увеличением температуры;
-
уменьшением температуры;
-
увеличением давления;
-
уменьшением давления;
-
разбавлением исходного бутана азотом;
-
разбавлением исходного бутана водородом;
2.2.12. Как увеличить равновесную степень превращения СО в реакции паровой конверсии оксида углерода?
-
увеличением температуры;
-
уменьшением температуры;
-
увеличением давления;
-
уменьшением давления;
-
увеличением начальной концентрации СO;
-
увеличением начальной концентрации водяного пара;
2.2.13. Укажите зависимости константы равновесия Кр от температуры Т:
1)
![]() ; 2)
; 2)
![]() ;
;
3)
![]() ; 4)
; 4)
![]() ;
5)
;
5)
![]() .
.
2.2.14. Как влияет повышение давления на сажеобразование в реакции
СО + Н2 С(тв) + Н2О?
-
сажеобразование увеличивается;
-
сажеобразование уменьшается;
-
не влияет.
2.2.15. Чем характеризуется химическое равновесие в замкнутой системе?
-
максимальным значением энергии Гиббса;
-
минимальным значением энергии Гиббса;
-
минимальным значением внутренней энергии;
-
максимальным значением энтропии;
-
минимальным значением энтропии.
2.2.16. Укажите правильное выражение для константы равновесия Кр реакции С(тв) + СО2 (г) = 2 СО (г):
1)
 ; 2)
; 2)
 ; 3)
; 3)
![]() ; 4)
; 4)
![]() .
.
2.3. Кинетика химических превращений
2.3.1. Что такое скорость химического превращения?
-
изменение концентрации во времени;
-
изменение количества вещества во времени;
-
изменение во времени количества вещества в единице объема;
-
соотношение количества образовавшихся продуктов и количества исходных веществ.
2.3.2. Различаются ли понятия "скорость химической реакции" и "скорость химического превращения вещества" и почему"?
-
нет, так как оба понятия определяют одно и то же – как быстро протекает превращение;
-
нет, так как скоростью превращения вещества измеряют скорость реакции;
-
да, так как значения скорости превращения вещества различны для разных участников реакции, а скорость реакции не может быть многозначной.
2.3.3. Сопоставьте тип реакции и вид зависимости ее скорости от температуры:
A)
простая обратимая экзотермическая
реакция;
Б)
простая необратимая экзотермическая
реакция;
В)
простая обратимая эндотермическая
реакция.

1

2
 3
3
2.3.4. Каким уравнением характеризуют зависимость константы скорости реакции k от температуры T?
1)
![]() ;
2)
;
2)
![]() ;
3)
;
3)
![]() ;
4)
;
4)
![]()
2.3.5. Какая существует зависимость скорости необратимой реакции от температуры?
-
прямая зависимость;
-
обратная зависимость;
-
экспоненциальная зависимость;
-
экстремальная зависимость.
2.3.6. На графике приведены зависимости скорости простых необратимых реакций от температуры с разными энергиями активации Е1 и Е2. Какое соотношение между Е1 и Е2?
Е1
> Е2;
Е1
< Е2;
Е1
Е2.
2.3.7. Сопоставьте порядок простой необратимой реакции n и вид зависимости ее скорости от концентрации c:

А)
n
= 0;
Б)
n
= 1;
В)
n
> 1;
Г)
n
< 1.
 2
2
 3
3
 4
4
2.3.8. Сопоставьте порядок простой необратимой реакции n и вид зависимости ее скорости r от степени превращения х исходного вещества

А)
n
= 0;
Б)
n
= 1;
В)
n
> 1;
Г)
n
< 1.

 2
2
 3
3
 4
4
2 .3.9.
Сопоставьте
вид сложной реакции и вид зависимости
дифференциальной избирательности от
степени превращения исходного вещества
(глубины протекания реакции)
.3.9.
Сопоставьте
вид сложной реакции и вид зависимости
дифференциальной избирательности от
степени превращения исходного вещества
(глубины протекания реакции)
А) последовательная
реакция;
Б)
параллельная реакция, n1
> n2
(n1,
n2
– порядки целевой и побочной реакций);
В)
параллельная реакция, n1
< n2;
Г)
параллельная реакция, n1
= n2.
 2
2
 3
3
 4
4
2 .3.10.
Как меняется дифференциальная
селективность SR
для параллель-
n1
R
.3.10.
Как меняется дифференциальная
селективность SR
для параллель-
n1
R
н ой
реакции А
с
увеличением концентрации исходного
вещества А,
n2
S
ой
реакции А
с
увеличением концентрации исходного
вещества А,
n2
S
если n1 > n2?
-
увеличивается;
-
уменьшается;
-
не меняется.
2 .3.11.
Как меняется дифференциальная
селективность SR
для параллель-
n1
R
.3.11.
Как меняется дифференциальная
селективность SR
для параллель-
n1
R
н ой
реакции А
с
увеличением степени превращения
исходного
n2
S
ой
реакции А
с
увеличением степени превращения
исходного
n2
S
вещества А, если n1 > n2?
-
увеличивается;
-
уменьшается;
-
не меняется.
