
- •Содержание
- •Введение
- •Лабораторная работа №1 изготовление моделей молекул углеводородов и галогенопроизводных
- •Лабораторная работа №2 качественный анализ органических соединений
- •Качественный элементный анализ органических соединений
- •Окрашивание пламени (предварительная проба)
- •Лабораторная работа №3 получение этилена и дибромэтана. Свойства алкенов
- •Лабораторная работа №4 получение ускусной кислоты. Свойства карбоновых кислот и альдегидов
- •Часть I. Соберите прибор для
- •Часть 3.Окисление альдегидов гидрокисдом меди (II).
- •Часть 4. Окисление альдегидов оксидом серебра (I).
- •Часть 5.Взаимодействие уксусной кислоты с некоторыми металлами
- •Лабораторная работа №5 изучение свойств спиртов
Часть I. Соберите прибор для
получения
уксусной кислоты (рис. 8). В пробирку
внесите 3 г кристаллического ацетата
натрия и прилейте 3 мл серной кислоты
(1:1). Закройте пробирку пробкой с
газоотводной трубкой, конец которой
опустите в пустую пробирку до дна.
Начните нагревать смесь исходных
веществ. Равновесие химической реакции
при нагревании смещается в сторону
образования уксусной кислоты, Рис.
8. Прибор
для получения уксусной кислоты
которая,
являясь
летучим веществом, уходит
из сферы реакции и конденсируется в
приемной пробирке. Когда в этой пробирке
соберется 2—3 мл кислоты, прекратите
нагревание.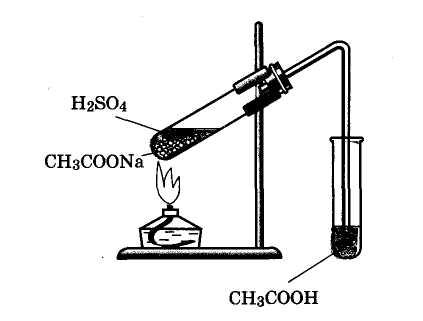
Отметьте физические свойства уксусной кислоты. Разбавьте полученную уксусную кислоту наполовину водой и разделите на четыре части. В одну пробирку с уксусной кислотой добавьте несколько капель раствора лакмуса, затем нейтрализуйте ее раствором щелочи (т.е. добавьте 20%-ный раствор гидрокисда натрия).
Во вторую пробирку насыпьте в кислоту немного порошка магния.
В оставшиеся две пробирки с уксусной кислотой внесите соответственно оксид магния и раствор карбоната натрия.
Составьте полные и сокращенные ионные уравнения наблюдаемых реакций.
Часть 2. Получите из мыла карбоновую кислоту (назовем условно ее стеариновой кислотой). Для этого в химический стаканчик налейте до половины его объема раствор мыла, прилейте к раствору 5—6 мл соляной кислоты (1:1) и перемешайте содержимое палочкой.
Что представляют собой образовавшиеся хлопья? Когда все хлопья всплывут на поверхность, с помощью шпателя перенесите карбоновую (стеариновую) кислоту на фильтровальную бумагу. Отметьте ее физические свойства.
Перенесите несколько крупинок стеариновой кислоты в пробирку и прилейте 2—3 мл раствора щелочи (20%-ный раствора гидрокисда натрия), встряхните. Что вы наблюдаете?
Опыт №2. Свойства карбоновых кислот и альдегидов.
Часть 3.Окисление альдегидов гидрокисдом меди (II).
Налейте в пробирку 2 мл 10 % раствора щелочи (NaOH) и добавьте 2…3 капли (не более) 2% раствора сульфата меди (CuSO4). К полученному свежеприготовленному гидроксиду меди (II)Cu(OH)2прилейте 1 мл раствора метаналя (формальдегида). Начинайтенагреватьсодержимое пробирки, при этом наблюдайте за происходящими в ней изменениями. Сначала происходит пожелтение смеси (образование осадка гидроксида одновалентной меди), а затем образование оксида меди (I) красного цвета. Часто на сильно нагретой стенке пробирки появляется налет металлической меди. Данная реакция является характерной на альдегиды и используется для их обнаружения.
Часть 4. Окисление альдегидов оксидом серебра (I).
Тщательно вымойте пробирку. Для этого налейте в нее концентрированный раствор гидрокисда натрия и несколько минут нагревайте до кипения. Затем гидрокисд натрия вылейте и пробирку несколько раз сполосните дистиллированной водой.
Для приготовления аммиачного раствора оксида серебра в пробирку налейте 2 мл раствора нитрата серебра и малыми порциями добавьте раствор аммиака. При внесении первых порций водного аммиака выпадает темный осадок оксида серебра, который в дальнейшем растворяется. Когда весь оксид серебра растворится, приливание аммиака прекратите.
К аммиачному раствору оксида серебра прилейте 1 мл раствора альдегида. Не встряхивая смесь, нагрейте пробирку в пламени. Вы увидите на стенках пробирки зеркальный налет металлического серебра. Остатки слейте в склянку для отходов.
Что является в данной реакции окислителем и восстановителем?
