
- •Содержание
- •Введение
- •Лабораторная работа №1 изготовление моделей молекул углеводородов и галогенопроизводных
- •Лабораторная работа №2 качественный анализ органических соединений
- •Качественный элементный анализ органических соединений
- •Окрашивание пламени (предварительная проба)
- •Лабораторная работа №3 получение этилена и дибромэтана. Свойства алкенов
- •Лабораторная работа №4 получение ускусной кислоты. Свойства карбоновых кислот и альдегидов
- •Часть I. Соберите прибор для
- •Часть 3.Окисление альдегидов гидрокисдом меди (II).
- •Часть 4. Окисление альдегидов оксидом серебра (I).
- •Часть 5.Взаимодействие уксусной кислоты с некоторыми металлами
- •Лабораторная работа №5 изучение свойств спиртов
Лабораторная работа №4 получение ускусной кислоты. Свойства карбоновых кислот и альдегидов
ЦЕЛЬ РАБОТЫ: изучить лабораторный способ получения уксусной кислоты и характерные свойства альдегидов и карбоновых кислот.
РАБОЧЕЕ ЗАДАНИЕ:
получить уксусную кислоту из ацетата натрия и изучить ее свойства;
получить из мыла жирную кислоту и изучить ее свойства;
изучить свойства альдегидов на примере метаналя (формальдегида) или этаналя (ацетальдегида).
ОБЩИЕ СВЕДЕНИЯ
Альдегиды – это органические вещества, в молекулах которых содержится функциональная группа (– С – Н), называемая карбонильной.
||
О
Наличие альдегидной группы в молекуле определяет характерные свойства альдегидов, для которых наиболее характерными являются реакции окисления и присоединения.
Присоединение водорода к молекулам альдегидов происходит по двойной связи в карбонильной группе:

Продуктом гидрирования альдегидов являются первичные спирты. Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт:
![]()
Гидрирование альдегидов — реакция восстановления, при которой понижается степень окисления атома углерода, входящего в карбонильную группу.
Альдегиды способны не только восстанавливаться, но и окисляться. При окислении альдегиды образуют карбоновые кислоты. Схематично этот процесс можно представить так:
![]()
Альдегиды окисляются даже кислородом воздуха и такими слабыми окислителями, как аммиачный раствор оксида серебра. В упрощенном виде этот процесс можно выразить уравнением реакции:
![]()
Например:

Более точно этот процесс отражают уравнения:
![]()
Если поверхность сосуда, в котором проводится реакция, была предварительно обезжирена, то образующееся в ходе реакции серебро покрывает ее тонкой ровной пленкой. Получается замечательное серебряное зеркало. Поэтому эту реакцию называют реакцией «серебряного зеркала». Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Ее широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Окислителем альдегидов может выступать и свежеосажденный гидроксид меди (II). Окисляя альдегид, Сu2+ восстанавливается до Сu+. Образующийся в ходе реакции гидроксид меди (I) СuОН сразу разлагается на оксид меди (I) красного цвета и воду:

Альдегиды могут раздражать слизистые оболочки глаз и верхних дыхательных путей, вредно влиять на нервную систему.
Формальдегид присутствует в организме не в свободной форме, которая токсична, а в гидратной, связанной с коферментом.
Формальдегид содержится в древесном дыме и является одним из агентов, обеспечивающих консервирующее действие в ходе копчения пищевых продуктов.
Бактерицидное действие формальдегида связано с его способностью реагировать с типичными для белков группами —NH—и —NH2, соединяя соседние белковые молекулы. Это приводит к повышению твердости веществ и лишает белки возможности выполнять их функции.
Карбоновые кислоты – соединения, молекулы которых содержат карбоксильную группу – СООН (карбоксильная группа атомов может рассматриваться как объединение двух функциональных групп – карбонильной и гидрокисльной). Общая формула карбоновых кислот R – COOH.
В отличие от альдегидов, карбонильная группа в карбоксиле неактивна, но повышает кислотность гидрокисльной группы, сдвигая на связи О-Н электронную плотность в сторону атома кислорода. При этом протон может отщепиться – кислота диссоциирует:

Общие свойства карбоновых кислот аналогичны соответствующим свойствам неорганических кислот: молекулы кислот в водном растворе диссоциируют, кислоты реагируют с металлами, с основными и амфотерными оксидами и гидроксидами, с солями более слабых и летучих кислот, могут образовывать кислотные оксиды (ангидриды), реагируют со спиртами. Карбоновые кислоты значительно слабее минеральных.
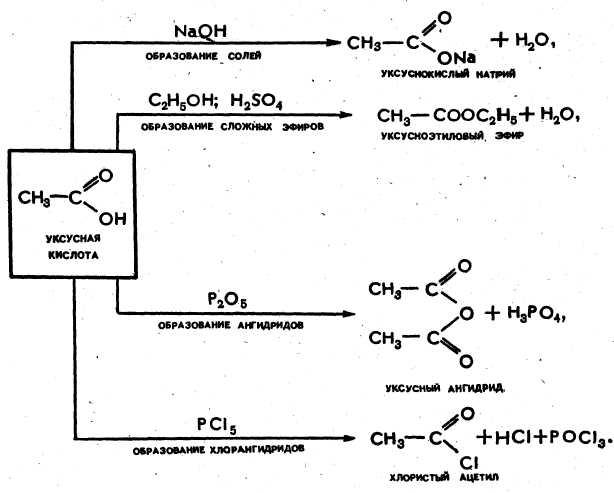
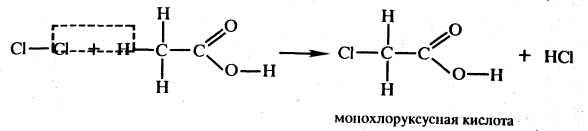
Карбоновые кислоты обладают и некоторыми специфическими свойствами, обусловленными наличием в их молекулах радикалов. Так, например, уксусная кислота реагирует с хлором:
 Современный
синтетический способ получения уксусной
кислоты
основан на окислении уксусного альдегида,
который в свою очередь получается из
ацетилена по реакции М.Г. Кучерова
(ацетилен получается
из очень доступного сырья - метана):
Современный
синтетический способ получения уксусной
кислоты
основан на окислении уксусного альдегида,
который в свою очередь получается из
ацетилена по реакции М.Г. Кучерова
(ацетилен получается
из очень доступного сырья - метана):
![]()
Большое значение приобретает новый способ получения уксусной кислоты, основанный на окислении бутана:

В то время как процесс получения уксусной кислоты из метана является многостадийным (метан→ацетилен→уксусный альдегид→уксусная кислота), ее получение окислением бутана сокращает число стадий, что дает большой экономический эффект.
В лабораторных условиях уксусную кислоту можно получить из ацетата натрия действием серной кислоты:
![]()
Уксусная кислота СН3СООН образуется при уксуснокислом брожении разбавленных водных растворов этанола, это основной компонент винного уксуса. В метаболических процессах участвует как сама кислота, так и ее соли.
ОБОРУДОВАНИЕ, МАТЕРИАЛЫ, РЕАКТИВЫ:
для опыта №1 – штатив лабораторный, штатив с пробирками, пробка с газоотводной трубкой, шпатель, стеклянная палочка, химический стакан (100 мл), горелка (спиртовка), спички, фильтровальная бумага; магний (порошок), оксид магния, 20%-ный раствор гидроксида натрия, растворы серной и соляной кислот (1:1), раствор мыла, раствор лакмуса, кристаллический ацетат натрия, 10% -ный раствор карбоната натрия, вода (в стакане).
для опыта №2 – штатив с мерными пробирками, горелка (спиртовка), спички; растворы уксусной кислоты и метаналя (1%), гранулированный цинк и магний (порошок), 10% -ный раствор гидроксида натрия, концентрированный раствор гидроксида натрия, 2%-ный раствор сульфата меди (II), свежеприготовленный 2% раствор нитрата серебра (I), раствор аммиака (5%), дистиллированная вода.
ХОД РАБОТЫ
Опыт №1. Получение и изучение свойств уксусной кислоты
