
- •Введение
- •Лабораторная работа № 1. Тепловой эффект химических реакций.
- •3.1. Энтропия и свободная энергия системы.
- •4. Объект исследования.
- •5. Контрольные вопросы:
- •6.Описание лабораторной установки и порядок проведения опыта.
- •7. Рекомендации по планированию и проведению эксперимента.
- •9. Список литературы.
- •10. Рекомендации по технике безопасности.
- •3.2. Факторы, влияющие на скорость химической реакции.
- •1. Влияние природы реагирующих веществ.
- •2. Влияние концентрации реагирующих веществ.
- •3. Влияние температуры на скорость реакции.
- •3.1. Примеры решения задач.
- •4. Объект исследования.
- •6. Описание лабораторной установки и порядок проведения опыта
- •7. Рекомендации по планированию и проведению эксперимента.
- •8. Составление отчета.
- •9. Список литературы.
- •10. Рекомендации по технике безопасности.
- •Лабораторная работа № 3.
- •3.1.2 Молярная концентрация.
- •4. Объект исследования.
- •5. Контрольные вопросы.
- •6. Описание лабораторной установки и порядок выполнения опыта.
- •7. Рекомендации по планированию и проведению эксперимента.
- •Катодные процессы в водных растворах
- •Анодные процессы в водных растворах
- •4. Объект исследования.
- •5. Контрольные вопросы.
- •6. Описание лабораторной установки и порядок выполнения опыта.
- •7. Рекомендации по планированию и проведению эксперимента.
- •3.1. Защита металлов от коррозии.
- •4. Объект исследования.
- •6. Описание лабораторной установки и порядок выполнения опыта.
- •Лабораторная работа №6
- •3.3. Химические свойства оксидов
- •3.4. Химические свойства оснований
- •3.5. Химические свойства кислот
- •4. Объект исследования.
- •5.Контрольные вопросы.
- •6. Описание лабораторной установки и порядок выполнения опыта.
- •I часть. Получение оксидов и гидроксидов
- •II часть. Получение солей
- •Номенклатура кислот и их солей
- •VI. Рекомендации по планированию и проведению эксперимента
- •VII. Составление отчета
- •Лабораторная работа № 7. Очистка сточных вод.
- •3. Общие сведения:
- •3.1 Методы и оборудование для очистки сточных вод.
- •3.2 Метод ионного обмена.
- •3.3 Мембранные методы очистки сточных вод.
- •3.4 Электродиализ.
- •3.5 Биологическая очистка сточных вод.
- •4. Объект исследования.
- •5.Контрольные вопросы.
- •7.Рекомендации по планированию и проведению эксперимента.
- •Подготовка химических опытов
- •Проведение химического опыта
- •Общие требования к поведению студентов в лаборатории химии
- •Работа с веществами и растворами
- •Обращение с нагревательными приборами, нагревание
- •Работы после окончания химических опытов
- •Первая помощь при повреждениях, вызванных химикатами, и при ожогах
7. Рекомендации по планированию и проведению эксперимента.
1. График построить на миллиметровой бумаге.
2. Причиной высокого значения относительной ошибки результатов опыта является несовершенство упрощенного калориметра.
СОСТАВЛЕНИЕ ОТЧЕТА.
1. Цель работы, задание
2. Порядок проведения опыт
3. Задание.
4. Таблица экспериментальных данных.
5. Рисунок калориметра (рис.1)
6. График с определением ΔТ на миллиметровой бумаге, размером 15на15 см включить в отчет (рис.2).
7. Описание опыта.
8. .Расчет ΔН и относительной погрешности η в %.
9. Вывод
10. Ответы на контрольные вопросы.

Рис. 1 Калориметр.
Внешний стакан
Крышка
Теплоизоляционная прокладка
Калориметрическая жидкость
Внутренний калориметрический стакан
Термометр
Отверстия для внесения испытуемых веществ
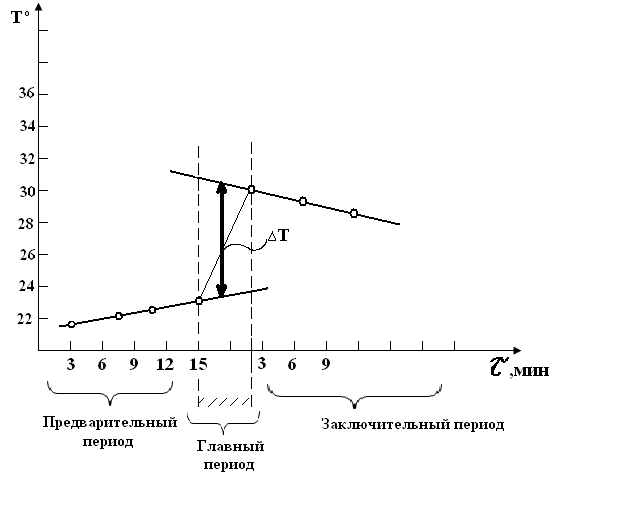
рис. 2
Графическое определение ΔТ.
9. Список литературы.
1..Глинка Н.Л. Задачи и упражнения по общей химии . Москва: Интеграл –
пресс, 2001 – 2006,66 -79 с.
2. Коровин Н. В. Общая химия. – М.: Высшая школа, 2004,116 -141 с.
3.Белозерова Т.И. Химия. Конспект лекций. в двух частях для. инженерно- технических ( нехимических) специальностей.- Северодвинск: Севмашвтуз., 2009г.,часть1.
4. Белозерова Т.И. Термохимические расчеты. Химическое равновесие. Правило Ле Шателье. Методические указания к практическим работам. Севмашвтуз, 2006,
14с.
10. Рекомендации по технике безопасности.
1. Соблюдайте осторожность при работе с термометром и с раствором щелочи.
2 В случае попадания щелочи на одежду следует смыть её водой, а затем нейтрализовать раствором уксусной кислоты с массовой долей 5%.
3.При попадании на лицо, глаза и на руки химических реактивов следует промыть пораженный участок большим количеством воды.
4.Не оставляйте на рабочих местах грязную посуду.
Лабораторная работа № 2.
Зависимость скорости реакции от концентрации реагирующих веществ и температуры.
1. ЦЕЛЬ РАБОТЫ: Установить зависимость скорости реакции от концентрации реагирующих веществ .
2. РАБОЧЕЕ ЗАДАНИЕ: Проделать опыты. Ответить на контрольные вопросы.
3.ОБЩИЕ СВЕДЕНИЯ
3.1. ПОНЯТИЕ О СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ.
Скоростью химической реакции (υ) называется изменение концентрации реагирующих веществ в единицу времени.
По изменении концентрации одного из веществ, участвующих в реакции можно судить об изменении концентрации всех остальных веществ.
Пусть
за промежуток времени от ![]()
![]() до
до ![]() концентрации некоторых веществ изменились
с
концентрации некоторых веществ изменились
с ![]() до
до ![]() .
Тогда средняя скорость реакции в среднем
интервале времени равна:
.
Тогда средняя скорость реакции в среднем
интервале времени равна:

![]()
где:
![]() и
и ![]() – концентрации веществ, [моль/л];
– концентрации веществ, [моль/л];
![]() и
и
![]() – время, [мин, сек];
– время, [мин, сек];
υ ср – скорость реакции, [моль/л*сек; моль/см3*мин]
Различают гомогенные и гетерогенные реакции.
Реакции, протекающие в однородной среде, называют гомогенными. Эти реакции идут по всему объёму системы
Гетерогенными называют реакции, идущие на поверхности соприкосновения твёрдого вещества и газа, твёрдого вещества и жидкости.
1)Н2(г)+J2(г)=2НJ(г)-гомогенная реакция
2)2Nа(тв)+2Н2О(ж)=2NаOH(р-р)+Н2(г)-гетерогенная реакция.
Для гетерогенных процессов скорость определяется изменением концентрации реагирующих веществ или образовавшихся в ходе реакции за единицу времени на единице поверхности.
![]()
![]()
