
- •Материаловедение и технология материалов
- •Часть II. Материаловедение
- •Материаловедение и технология материалов
- •Часть II. Материаловедение
- •Введение
- •Содержание
- •Практическая работа №7
- •Теоретическая часть
- •Кристаллографические обозначения атомных плоскостей и направлений
- •Расчет теоретической плотности кристаллических веществ
- •Сведения об атомных весах и плотности металлов
- •Формулы для расчета объема элементарной ячейки
- •Теоретическая часть
- •Содержание отчета
- •Виды диаграмм растяжения металлических материалов с различным типом кристаллических решеток
- •Испытания на твердость
- •Деформация
- •Фазы и структура в металлических сплавах
- •Диаграммы состояния двойных систем
- •Метод построения диаграмм состояния
- •Правило отрезков
- •Диаграмма состояния системы с неограниченной растворимостью компонентов в твердом состоянии
- •Диаграмма состояния системы с механической смесью компонентов в твердом состоянии
- •Диаграмма состояния системы с образованием ограниченных твердых растворов
- •Диаграмма состояния системы с химическим соединением
- •Диаграмма состояния системы, компоненты которой претерпевают полиморфные превращения
- •Диаграмма состояния сплавов, образующих ограниченные твердые растворы и претерпевающих перитектическое превращение
- •Пример выполнения практической работы «Построение и анализ диаграмм состояния двойных систем»
- •Работа №10
- •Теоретическая часть
- •Компоненты и фазы в железоуглеродистых сплавах
- •Основные линии и точки на диаграмме железо – углерод
- •Анализ процессов охлаждения железоуглеродистых сплавов различного состава
- •Пример кристаллизации сплава
- •На структуру железо-углеродистых сплавов
- •Превращения в стали при нагреве и охлаждении
- •Отжиг стали
- •Нормализация
- •Закалка стали
- •Отпуск стали
- •Старение
- •Нормализация
- •Термомеханическая обработка
- •Отжиг I рода
- •Отжиг II рода
- •Нормализация
- •Закалка
- •Способы закалки
- •Отпуск закаленных сталей
- •Работа №12
- •Часть II. Материаловедение.
Фазы и структура в металлических сплавах
В зависимости от природы сплавляемых компонентов они, взаимодействуя друг с другом, могут образовывать различные по строению и свойствам продукты (фазы). Характер физико-химического взаимодействия компонентов при сплавлении зависит от положения их в периодической таблице Д.И. Менделеева, то есть от особенностей строения электронных оболочек атомов, типов и параметров кристаллических решеток, соотношения температур плавления, размеров атомов и др.
В зависимости от перечисленных факторов компоненты при сплавлении могут образовывать:
Жидкие растворы – неограниченно растворимые друг в друге расплавы компонентов, находящихся выше температур их плавления;
Механические смеси – конгломерат фаз компонентов системы с пренебрежимо малой взаимной растворимостью. Смеси состоят из практически чистых зерен обоих компонентов, сохраняющих присущие им типы кристаллических решеток и физико-механические свойства;
Твердые растворы – фазы на основе компонентов системы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку (растворитель), а атомы других (или другого) компонентов (растворенное вещество) располагаются в решетке первого компонента, изменяя ее размеры (периоды). В результате твердый раствор, состоящий из двух или нескольких компонентов, имеет один тип решетки и представляет собой одну фазу.
Если атомы растворимого компонента замещают в узлах кристаллической решетки атомы компонента - растворителя, то образующийся раствор называется твердым раствором замещения (рис. 1а).
Все металлы могут в той или иной степени взаимно растворяться друг в друге в твердом состоянии. Взаимная растворимость определяется типом кристаллических решеток и электронным строением оболочек атомов взаимодействующих элементов. Чаще всего растворимость бывает ограниченной и в случае превышения предельной растворимости растворенное вещество образует собственную фазу. Однако в ряде случаев компоненты могут замещать друг друга в кристаллических решетках в любых количествах (неограниченно), образуя непрерывный ряд твердых растворов.
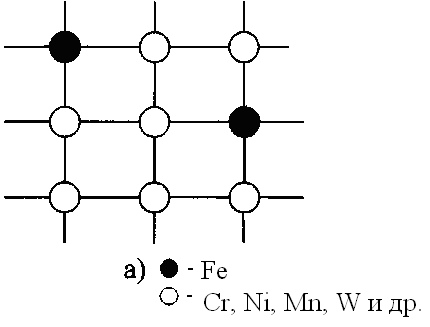

Рис. 1 Виды твердых растворов:
а – замещения; б - внедрения
Для образования твердых растворов замещения с неограниченной растворимостью компонентов друг в друге необходимо соблюдение следующих условий:
компоненты должны обладать одинаковыми по типу кристаллическими решетками;
различие в атомных размерах компонентов должно быть незначительным и не превышать 8-15%;
компоненты должны принадлежать к одной и той же группе Периодической системы элементов или к смежным родственным группам и в связи с этим иметь близкое строение валентной оболочки электронов в атомах.
Указанные условия являются необходимыми, но недостаточными и даже при их соблюдении непрерывный ряд твердых растворов может не возникнуть
Если растворимый компонент имеет очень малый атомный диаметр, то образуется твердый раствор внедрения (рис. 1б). В этом случае энергозатраты на образование раствора оказываются меньшими, т.к. атомы растворимого компонента размещаются в междоузлии ячеек кристаллической решетки растворителя, не вытесняя атомов растворителя из узлов решетки. При этом атомы располагаются не в любом междоузлии, а в таких пустотах, где для них имеется большое свободное пространство (например, для ГЦК решетки наиболее подходящей будет октаэдрическая пора в центре куба). Твердые растворы внедрения могут быть только с ограниченной растворимостью, т.к. число пор в кристаллической решетке всегда ограничено, а атомы растворителя всегда сохраняются в узлах решетки. Как правило, растворимость внедренных атомов не превышает 1-2 %.
При образовании твердых растворов кристаллическая решетка всегда искажается и периоды ее изменяются. Так при образовании твердого раствора замещения период решетки может увеличиваться или уменьшаться в зависимости от соотношения атомных радиусов растворителя и растворенного компонентов. В случае же твердого раствора внедрения период решетки растворителя всегда возрастает (см. рис 2 а, б и в).
Химические соединении - фазы на основе компонентов системы, при образовании которых они теряют свой тип кристаллической решетки и образуют совместно новый тип. Характерными для химических соединений, образованных по закону нормальной валентности, являются следующие закономерности:
атомы в решетке химического соединения располагаются упорядочено, т.е. атомы каждого компонента расположены закономерно и по определенным узлам решетки, образуя сложную кристаллическую структуру;
в соединении всегда сохраняется простое кратное соотношение компонентов, что позволяет выразить их состав простой формулой АmВn , где А и В – соответствующие элементы; m и n – простые числа;
свойства соединения резко отличаются от свойств образующих его компонентов;
температура плавления (диссоциации) постоянная, что позволяет графически на диаграмме изобразить химическое соединение в виде прямой вертикальной линии;
образование химического соединения сопровождается значительным тепловым эффектом.



а б в
Рис 2 Искажение кристаллической решеткой растворителя
при образовании твердых растворов замещения (а, б) и внедрения (в)
В отличие от твердых растворов химические соединения обычно образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток. Необходимо заметить, что указанные закономерности не всегда полностью выполняются и в металлических сплавах образуется большое количество химических соединений, которые по некоторым особенностям отличаются от типичных химических соединений, так как не подчиняются законам валентности и не имеют постоянного состава. Химические соединения образуются между разными элементами и имеют собственные названия.
Соединения одних металлов с другими носят общее название интерметалидов или интерметаллических соединений.
Соединения металлов с не металлом, которые могут обладать металлической связью, называют металлическими соединениями. Наиболее важными химическими соединениями являются фазы внедрения, электронные соединения и фазы Лавеса.
Строение металлических сплавов зависит от того, в какие взаимодействия вступают компоненты, образующие систему при этом под структурой понимают форму, размеры и характер взаимного расположения фаз в конкретной системе, которая может быть двух или много компонентной. Структуру сплавов можно наблюдать либо невооруженным глазом (макроанализ), либо при больших увеличениях с помощью микроскопов (микроанализ).
