
Экзамен / ответыКПК
.pdf
При седиментационном анализе дисперсности полидисперсных систем определяют время осаждения частиц отдельных фракций, рассчитывают скорости их осаждения и соответствующие им размеры частиц. Для этого сначала измеряют зависимость массы осевшего осадка от времени, строят график этой зависимости, называемой кривой седиментации, по которому затем определяют все необходимые характеристики дисперсной системы.
Имеются графические и аналитические методы расчета кривой седиментации.
Реальная кривая седиментации полидисперсной системы обычно получается плавной и ей отвечает множество бесконечно малых участков, касательные в каждой точке этой кривой отражают седиментацию данной бесконечно
малой фракции. Результаты
седиментациоиного
анализа дисперсности полиднсперсных систем представляют также в виде кривых распределения частиц по размерам, характеризующих степень полиднсперсности системы.
Кривая распределения является наглядной и удобной характеристикой полидисперсности системы, по которой легко определить содержание различных фракций. Ее строят подобно кривой распределения пор по размерам. Обычно сначала получают интегральную кривую распределения, проводят ее выравнивание с учетом точности получаемых средних значений радиусов частиц фракций и затем по ней строят дифференциальную кривую распределения. Иногда дифференциальную кривую строят сразу. На оси абсцисс откладывают значения радиусов; на ось ординат наносят отношение приращения массовых долей к разности радиусов частиц соседних фракций ∆x/∆ri. Построив на графике отдельные прямоугольники для каждой фракции (гистограмму) и соединив плавной кривой середины их верхних сторон, получают дифференциальную кривую распределения частиц полидисперсной системы по размерам.
3. Используя уравнение Эйнштейна, рассчитайте вязкость золя AgCl, имеющего концентрацию 10% массовых и содержащего сферические частицы. Плотность AgCl: 5,56·103 кг\м3; вязкость и плотность дисперсионной среды составляют 1·10-3 Па·с и 1000 кг/м3 соответственно.


Экзаменационный билет
№6
1.Влияние дисперсности на термодинамическую реакционную способность. Вывод уравнения капиллярной конденсации Кельвина. Влияние дисперсности на растворимость, константу равновесия химической реакции и температуру фазового перехода.
Термодинамическая реакционная способность характеризует способность вещества переходить в какое-либо иное состояние, например переходить в другую фазу, вступать в химическую реакцию. Она указывает на удаленность данного состояния вешества или системы компонентов от равновесного состояния при определенных условиях. Термодинамическая реакционная способность определяется химическим сродством, которое можно выразить изменением энергии Гиббса или разностью химических потенциалов.
Реакционная способность зависит от степени дисперсности вещества, изменение которой может приводить к сдвигу фазового или химического равновесия.
Соответствующее приращение энергии Гиббса
dGд (благодаря изменению дисперсности) можно представить в виде объединенного уравнения первого и второго начал термодинамики:
Для индивидуального вещества V=Vм и при
Т=const имеем:
Подставляя в это уравнение соотношение Лапласа, получим:
для сферической кривизны: Если рассматривается переход вещества из конденсированной фазы в газообразную, то энергию Гиббса можно выразить через давление пара, приняв его за идеальный. Дополнительное изменение энергии Гиббса, связанное с изменением дисперсности,
Если рассматривается переход вещества из конденсированной фазы в газообразную, то энергию Гиббса можно выразить через давление пара, приняв его за идеальный. Дополнительное изменение энергии Гиббса, связанное с изменением дисперсности,
составляет: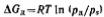
Подставляя данное выражение, получим:
Полученное соотношение называется уравнением Кельвина (уравнение капиллярной конденсации). Для неэлектролитов его можно записать следующим образом:
Из этого уравнения видно, что с увеличением дисперсности растворимость растет, или химический потенциал частиц дисперсной системы больше, чем у крупной частицы, на величину
2σV/r.
Степень дисперсности может влиять также на равновесие химической реакции:
Сувеличением дисперсности повышается активность компонентов, а в соответствии с этим изменяется константа химического равновесия в ту или другую сторону, в зависимости от степени дисперсности исходных веществ и продуктов реакции.
Сизменением дисперсности веществ изменяется температура фазового перехода.
Количественная взаимосвязь между температурой фазового перехода и дисперсностью вытекает из термодинамических соотношений.

Для |
|
фазового |
перехода: |
, |
|
Для |
сферических |
частиц: |
Видно, что с уменьшением размера частиц г температуры плавления и испарения вещества уменьшаются (Hф.п.>0).
2. Природа броуновского движения. Понятие и определение среднеквадратичного сдвига по выбранному направлению. Взаимосвязь между среднеквадратичным сдвигом и коэффициентом диффузии (ввод уравнения Эйнштейна-Смолуховского).
Основой доказательства теплового молекулярного движения в телах явилось обнаруженное английским ботаником Робертом Броуном в 1827 г. с помощью микроскопа непрерывное движете очень мелких частичек — спор папоротника (цветочной пыльцы), взвешенных в воде. Более крупные частицы находились в состоянии постоянного колебания около положения равновесия. Колебания и перемещения частиц ускорялись с уменьшением их размера и повышением температуры и не были связаны с какими-либо внешними механическими воздействиями.
Теоретически обоснованная интерпретация броуновского движения — участие частиц дисперсной фазы ультрамикрогетерогенных систем в тепловом движении — была дана независимо друг от друга Эйнштейнии (1905 г.) и Смолуховским (1906 г.).
Проведенными исследованиями была окончательно доказана природа броуновского движения. Молекулы среды (жидкости или газа) сталкиваются с частицей дисперсной фазы, в результате чего она получает огромное число ударов со всех сторон.
|
Эйнштейн и Смолуховский |
|||
для |
количественного |
выражения |
||
|
броуновского |
движения |
||
частиц |
ввели |
представление |
о |
|
|
среднем |
сдвиге |
частицы. |
|
Если при наблюдении движения частицы золя под микроскопом через определенные равные промежутки времени отмечать ее местонахождение, то можно получить ее траекторию движения. Так как движение происходит в трехмерном пространстве, то квадрат среднего расстояния, проходимого частицей за
любой промежуток времени, равен  . Под микроскопам наблюдают проекцию смещения частицы на плоскость за какое-то время,
. Под микроскопам наблюдают проекцию смещения частицы на плоскость за какое-то время,
поэтому  .
.
При равновероятных отклонениях частицы ее направление будет находиться между направлениями x и у, т. е. под углом 45° к каждой
координате. |
Отсюда |
или |
 .
.
Из-за равновероятных отклонений среднеарифметическое значение сдвигов равно нулю. Поэтому используются среднеквадратичные расстояния, проходимые частицей:
Эйнштейн и Смолуховский, постулируя единство природы броуновского движения и теплового движения, установили количественную связь между средним сдвигом частицы (называемым иногда амплитудой смещения) и коэффициентом диффузии D.

Если броуновское движение является следствием теплового движения молекул среды, то можно говорить о тепловом движении частиц дисперсной фазы. Это означает, что дисперсная фаза, представляющая собой совокупность числа частиц, должна подчиняться тем же статистическим законам молекулярно-кинетической теории, приложимым к газам или растворам.
Для
связи
коэффициентом диффузии представим себе трубку с поперечным сечением S, наполненную золем, концентрация частиц которого уменьшается слева направо. В этом же направлении протекает и диффузия частиц золя (на рисуике отмечено стрелкой). Выделим по обе стороны от линии MN два малых участка 1 и 2, размеры которых в направлении диффузии равны ∆ — среднему квадратичному сдвигу за время τ. Обозначим частичную концентрацию золя в объемах этих участков соответственно через ν1 и ν2 (ν1>ν2). Хаотичность теплового движения приводит к равной вероятности переноса дисперсной фазы из обоих объемов вправо и влево от линии MN: половина частиц переместится вправо, а другая половина — влево. Количество дисперсной фазы за время τ переместится из объема 1 вправо:
 , а из объема 2 влево (в обратном
, а из объема 2 влево (в обратном
направлении): .
.
Так как |Q1| > |Q2| (ν1>ν2), то суммарное количество перенесенного вещества через плоскость MN вправо определится соотношением
 .
.
Градиент концентрации по расстоянию в направлении диффузии можно выразить так:
Подставляя, получим:
Сравнивая это соотношение с первым законом
диффузии Фика:  , окончательно имеем:
, окончательно имеем:
Это уравнение выражает закон Эйнштейна — Смолуховского, в соответствии с которым квадрат среднего сдвига пропорционален коэффициенту диффузии н времени.
3. Для отрицательно заряженного гидрозоля Al2S3, порог коагуляции при добавленном КСl равен 49 ммоль/л. Используя закон Дерягина, рассчитайте пороги коагуляции для таких электролитов как
Na2SO4, MgCl2 и AlCl3.


Экзаменационный билет
№7
1.Методы получения дисперсных систем: диспергирование и конденсация. Уравнение Ребиндера для работы диспергирования. Адсорбционное понижение прочности (эффект Ребиндера). Конденсация физическая и химическая. Энергия Гиббса образования зародыша новой фазы при гомогенной конденсации; роль пересыщения.
Диспергирование и конденсация — методы получения свободно-дисперсных систем: порошков, суспензий, золей, в том числе аэрозолей, эмульсий и т. д. Под диспергированием понимают дробление и измельчение вещества, под конденсацией — образование гетерогенной дисперсной системы из гомогенной в результате ассоциации молекул, атомов или ионов в агрегаты. Работа упругого и пластического деформирования пропорциональна объему тела:
Работа образования новой поверхности при диспергировании пропорциональна приращению
поверхности:  Полная работа, затрачиваемая на
Полная работа, затрачиваемая на
диспергирование, выражается уравнением Ребиндера:
Разрушение материалов может быть облегчено при использовании эффекта Ребиндера — адсорбционного понижения прочности твердых тел. Этот эффект заключается в уменьшении поверхностной энергии с помощью поверхностноактивных веществ, в результате чего облегчается деформирование и разрушение твердого тела.
Процесс конденсации предполагает образование новой фазы на уже имеющихся поверхностях (стенках сосуда, частицах посторонних веществ — ядрах конденсации) или на поверхности зародышей, возникающих самопроизвольно в результате флуктуации плотности и концентраций вещества в системе. В первом случае конденсация называется гетерогенной, во втором — гомогенной.
Чтобы сконденсированное вещество не возвращалось в первоначальную фазу и конденсация продолжалась, исходная система должна быть пересыщенной. В противном случае конденсация не может происходить, исчезают и зародыши конденсации (путем их испарения, растворения, плавления).
При гомогенной конденсации происходит самопроизвольное образование зародышей; энергия поверхности выступает в качестве потенциального барьера конденсации. Энергию Гиббса образования зародышей выражают (в соответствии с объединенным уравнением первого и второго начал термодинамики) в виде четырех составляющих: энтропийной, механической, поверхностной и химической.
Для жидких и газообразных фаз можно ограничиться двумя первыми составляющими энергии Гиббса образования зародышей.

Если
степень
пересыщения
меньше критической, то возникающие зародыши
самопроизвольно испаряются (растворяются). Их размеры меньше критического, поэтому энергия Гиббса понижается с уменьшением размера зародыша. Пересыщенный раствор или пар в этих условиях иногда удобно представить как гетерогенно-дисперсную систему, в которой присутствует множество постоянно образующихся и исчезающих зародышей новой фазы. В критической точке неустойчивость равновесия проявляется в том, что существует равная вероятность возникновения и исчезновения зародышей конденсации.
Если степень пересыщения больше критической величины, то возникающие зародыши будут самопроизвольно расти.
Критическая энергия Гиббса образования зародышей конденсации соответствует критической точке — максимуму функции ∆G =
f(r): 
Таким образом, энергия Гиббса образования зародышей при гомогенной конденсации равна одной трети поверхностной энергии зародыша. Если найти радиус зародыша в критической точке, приравняв к нулю первую производную от энергии Гиббса и подставить его в данное выражение, то получим:
Из этого соотношения следует, что энергия образования зародыша конденсации зависит от степени пересыщения, от нее же зависит и размер критического радиуса зародыша. Чем выше степень пересыщения, тем ниже энергия Гиббса образования зародышей и тем меньше размеры образующихся зародышей, способных к дальнейшему росту.
2. Седиментационно-диффузионное равновесие (гипсометрический закон). Вывод уравнения. Мера седиментационной устойчивости. Факторы, влияющие на седиментационную устойчивость дисперсных систем.
В золях через определенное, иногда очень длительное, время оседания частиц может наступить момент, когда диффузионный поток станет равным седиментационному iдиф = iсед, т.е. наступит диффузионно-седцментационное равновесие. Так как такое равновесие наступает при определенном градиенте концентраций, в системе должно установиться соответствующее распределение дисперсной фазы по высоте. Чтобы определить закон этого распределения, воспользуемся данным соотношением (iдиф = iсед), учтя, что
и заменив x на h (расстояние по высоте):
После разделения переменных получим:

Интегрируя в пределах от ν0 до νh и соответственно от h = 0 до h, найдем:
или
Это уравнение носит название гипсометрического закона (от лат. hypsos — высота).
Если сравнить седиментацию при наличии диффузии и без нее, то обращает на себя внимание различие факторов, обеспечивающих устойчивость дисперсных систем к осаждению — седиментационную устойчивость. Эти факторы позволяют различать кинетическую седиментационную устойчивость (КСУ) и термодинамическую седиментационную устойчивость (ТСУ).
Мерой кинетической седиментационной устойчивости является величина, обратная константе седиментации:
Мерой ТСУ является гипсометрическая высота. Ее удобнее определить как высоту he, на протяжении которой концентрация дисперсной фазы изменяется в е раз.
Данная формула показывает, что гипсометрическая высота и соответственно термодинамическая седиментационная устойчивость тем больше, чем меньше размер частиц и разность между плотностями частиц и среды. Вязкость не влияет на ТСУ, в то (же время повышение температуры способствует устойчивости, так как усиливается тепловое движение. Кинетическая же седиментационная устойчивость с повышением температуры обычно снижается в связи с уменьшением вязкости среды.
3. Электрофорез дисперсии бентонитовой глины происходит при следующих условиях: расстояние между электродами 25 см, напряжение 100 В, за 15 минут частицы переместились на 11 мм к аноду. Рассчитайте ζ- потенциал, учитывая, что ε = 78,2, а η = 9,9·10-4 Па·с.

