
Экзамен / ответыКПК
.pdf
участвуют в тепловом движении.
4.Структурно-механический фактор является кинетическим. Его действие обусловлено тем, что на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение которых требует затраты энергии и времени.
5.Гидродинамический фактор снижает скорость коагуляции благодаря изменению вязкости среды и плотности дисперсной фазы и дисперсионной среды.
6.Смешанные факторы наиболее характерны для реальных систем. Обычно агрегативная устойчивость обеспечивается несколькими факторами одновременно.
Коагуляция протекает в термодинамически неустойчивых (лиофобных) дисперсных системах,
иоб агрегативной устойчивости таких систем судят по скорости коагуляции.
Смолуховским была рассмотрена кинетика коагуляции монодисперсных золей со сферическими частицами, которые сталкиваются между собой в результате броуновского движения. Критическое расстояние, на котором осуществляется взаимодействие между частицами, принято приблизительно равным сумме радиусов частиц, что соответствует непосредственному их
контакту. Согласно представлениям Смолуховского при коагуляции происходят взаимодействия только между двумя частицами, так как вероятность одновременного столкновения большого числа частиц очень мала. Таким образом, сталкиваются частицы одиночные, образуя двойные, одиночные с двойными, двойные друг с другом, тройные с одиночными и т. д. Такое представление процесса коагуляции позволяет формально применить к нему теорию бимолекулярных химических реакций.
Относительное смещение двух частиц. ∆n—∆m с коэффициентом относительной диффузии Dnm связано законом Эйнштейна — Смолуховского:
В соответствии с первым законом Фика поток через сферическую поверхность s выражается уравнением
Интегрируя уравнение данное после разделения переменных в пределах от Rnm до ∞ и
соответственно от 0 до νn, получим:  Данное уравнение отражает также число столкновении на данной стадии процесса коагуляции, т. е. число частиц, сталкивающихся в единицу времени с одной центральной частицей. Общее число столкновений между частицами в системе в единицу времени в данный момент
Данное уравнение отражает также число столкновении на данной стадии процесса коагуляции, т. е. число частиц, сталкивающихся в единицу времени с одной центральной частицей. Общее число столкновений между частицами в системе в единицу времени в данный момент
составляет  .
.
Чтобы рассчитать скорость уменьшения числа частиц в результате коагуляции, т. е. скорость коагуляции, необходимо принять, что все столкновения приводят к агрегации. Необходимо учесть стерический множитель P, учитывающий благоприятные пространственные расположения частиц при столкновении, их форму, размеры. Тогда скорость коагуляции в данный момент времени составит:
Сравнение с уравнением для скорости бимолекулярной реакции  , показывает, что константа скорости коагуляции выражается следующим соотношением:
, показывает, что константа скорости коагуляции выражается следующим соотношением:
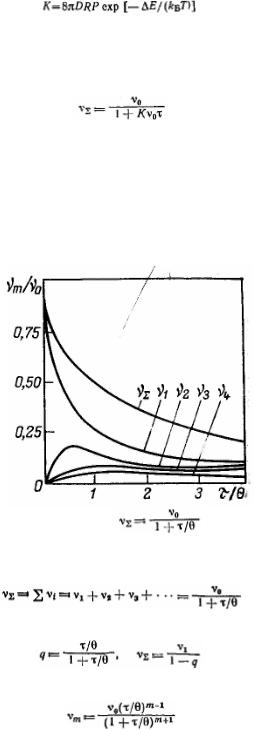
Общее число частиц в результате коагуляции уменьшается. Чтобы определить, каким оно будет через время τ, необходимо провести интегрирование в пределах от ν∑ = ν0 при τ = 0 до ν∑ при τ:
Константу скорости коагуляции теоретически определить трудно, поэтому Смолуховский ввел понятие времени (периода) половинной коагуляции θ — времени коагуляции, в течение которого общая концентрация частиц уменьшается до половины от начальной концентрации первичных (единичных) частиц. Из уравнения общего числа частиц следует:
 и .
и .
Общее число частиц ν∑ в единице объема системы представляет собой уменьшающуюся в процессе коагуляции сумму частиц всех порядков:
Этот ряд является суммой геометрической прогрессии со знаменателем
Отсюда легко определить число частиц каждого порядка (m-мерных):
Согласно теории кинетики коагуляции различают быструю и медленную коагуляцию. Для такого разделения можно воспользоваться уравнением константы скорости коагуляции. При быстрой коагуляции все столкновения частиц эффективны, т. е. приводят к слипанию частиц. При медленной коагуляции это утверждение не соблюдается.
3. Рассчитайте работу адгезии и коэффициент растекания для системы водаграфит, если известно, что краевой угол равен
90 º, а поверхностное наятжение воды 72 мДж/м2.


Экзаменационный билет
№24
1.Количественные характеристики пористых материалов: пористость, удельная поверхность, размер пор. Пористые тела корпускулярной, кристаллической и губчатой структуры, методы их получения. Классификации пор по Дубинину и теория адсорбции.
Пористые тела — это твердые тела, внутри которых имеются поры, обусловливающие наличие внутренней межфазной поверхности. Поры могут быть заполнены газом или жидкостью. Высокодисперсные пористые неорганические материалы, в частности, адсорбенты и катализаторы, получают в основном двумя методами. Один из них заключается в синтезе гидрозоля с последующей его коагуляцией для образования геля; гель высушивают. Частицы дисперсной фазы (корпускулы) в результате этих операций срастаются с образованием твердого каркаса. Так как частицы золя высокодисперсны, то получаемый пористый материал имеет большую удельную поверхность. Таким методом получают адсорбенты корпускулярной структуры.
Второй метод получения высокодисперсных пористых адсорбентов и катализаторов заключается в обработке крупнопористых материалов агрессивными газами или жидкостями. При такой обработке получаются пористые тела губчатой структуры.
Наибольшее распространение получила классификация пористых тел, предложенная M. M. Дубининым. По этой классификации за основу приняты размеры пор и механизм протекающих в них адсорбционных процессов. По классификации M. M. Дубинина пористые тела делятся на макропористые, переходнопористые, микропористые в зависимости от линейного размера, под которым понимают полуширину для щелевидной поры или радиус для сферической или цилиндрической поры.
Макропористые тела имеют поры радиусом больше 100,0 — 200,0 нм, удельная поверхность
макропористых тел находится в пределах 0,5 — 2 м2/г. В связи с тем, что такие поры намного больше адсорбируемых молекул, то их стенки по сравнению с молекулами можно рассматривать как ровные поверхности, поэтому для макропористых тел применима обобщенная теория адсорбции Ленгмюра.
Переходнопористые тела (или капиллярнопористые, или мезопористые) имеют размеры пор
в пределах от 1,5 до 100,0 — 200,0 нм их удельная поверхность составляет от 10 до 500 м2/г. Ha стенках этих пор при малых давлениях происходит полимолекулярная адсорбция паров, которая с увеличением давления заканчивается капиллярной конденсацией.
Микропористые тела обладают порами, соизмеримыми с размерами адсорбируемых молекул. Радиусы пор лежать в пределах от 0,5 до
1,5 нм. Удельная поверхность таких тел 500 — 1000 м2/г и выше. Отличительной чертой микропор является настолько близкое расположение противоположных стенок, что их поля поверхностных сил перекрываются и они действуют во всем объеме микропор.
Одной из основных характеристик пористой

структуры тела является пористость — отношение объема пор Vп к общему объему тела Vобщ:
Если принять, что поры в пористых телах и порошках имеют правильную форму, то их размеры можно оценить, зная пористость и
удельную поверхность:  Для определения пористости и удельной поверхности пористых тел широко используются адсорбционные методы.
Для определения пористости и удельной поверхности пористых тел широко используются адсорбционные методы.
2. Лиофильные дисперсные системы. Истинно растворимые и коллоидные ПАВ, их классификация. Мицеллообразование, строение мицелл, методы определения ККМ. Факторы, влияющие на ККМ.
Все дисперсные системы в зависимости от механизма процесса их образования по классификации П. А. Ребиндера подразделяют на лиофильные, которые получаются при самопроизвольном диспергировании одной из фаз (самопроизвольное образование гетерогенной свободнодисперсной системы), и лиофобные, получающиеся в результате диспергирования и конденсации с пересыщением (принудительное образование гетерогенной свободноднсперсной системы).
Наличие гидрофильной и олеофильной частей у молекул ПАВ является характерной отличительной особенностью их строения. По способности к диссоциации в водных растворах поверхностноактивные вещества делят на ионогенные и неионогенные. В свою очередь ионогенные ПАВ подразделяют на анионные, катионные и амфолитпые (амфотерные).
1)Анионные ПАВ диссоциируют в воде с образованием поверхностно-активного аниона.
2)Катионные ПАВ диссоциируют в воде с образованием поверхностно-активного катиона.
3)Амфолитные ПАВ содержат две функциональные группы, одна из которых имеет кислый, а другая основный характер, например карбоксильную и аминную группы. В зависимости от рН среды амфолитные ПАВ проявляют анионоактивные или катионоактивные свойства.
Все ПАВ относительно поведения их в воде делят на истинно растворимые и коллоидные. Истинно растворимые ПАВ в растворе находятся
вмолекулярно-дисперсном состоянии вплоть до концентраций, соответствующих их насыщенным растворам и разделению системы на две сплошные фазы.
Главной отличительной особенностью коллоидных ПАВ является способность образовывать термодинамически устойчивые (лиофильные) гетерогенные дисперсные системы (ассоциативные, или мицеллярные, коллоиды). К основным свойствам коллоидных ПАВ, обусловливающим их ценные качества и широкое применение, относятся высокая поверхностная активность; способность к самопроизвольному мицеллообразованию — образованию лиофильных коллоидных растворов при концентрации ПАВ выше некоторого определенного значения, называемого критической концентрацией мицеллообразования (KKM); способность к солюбилизации — резкому увеличению растворимости веществ в растворах коллоидных ПАВ вследствне их «внедрения» внутрь мицеллы; высокая способность стабилизировать различные дисперсные системы.
При концентрациях выше KKM молекулы ПАВ собираются в мицеллы (ассоциируют) и раствор

перехолит в мицеллярную (ассоциативную) коллоидную систему.
Под мицеллой ПАВ понимают ассоциат дифильных молекул, лиофильные группы которых обращены к соответствующему растворителю, а лиофобные группы соединяются друг с другом, образуя ядро мицеллы. Число молекул, составляющих мицеллу, называют числом ассоциации, а общую сумму молекулярных масс молекул в мицелле, или произведение массы мицеллы на число Авогадро, — мицеллярной массой. Определенное ориентирование дифильных молекул ПАВ в мицелле обеспечивает минимальное межфазное натяжение на границе мицелла — среда.
При
концен
трация х ПАВ
в
водном
раство ре, нескол
ько превышающих KKM, согласно представлениям Гартли образуются сферические мицеллы (мицеллы Гартли). Внутренняя часть мицелл Гартли состоит из переплетающихся углеводородных радикалов, полярные группы молекул ПАВ обращены в водную фазу. Диаметр таких мицелл равен удвоенной длине молекул ПАВ. Число молекул в мицелле быстро растет в пределах узкого интервала концентраций, а при дальнейшем увеличении концентрации практически не изменяется, а увеличивается число мицелл. Сферические мицеллы могут содержать от 20 до 100 молекул и более.
При увеличении концентрации ПАВ мицеллярная система проходит ряд равновесных состояний, различающихся по числам ассоциации, размерам и форме мицелл. При достижении определенной концентрации сферические мицеллы начинают взаимодействовать между собой, что способствует их деформации. Мицеллы стремятся принять цилиндрическую, дискообразную, палочкообразную, пластинчатую форму.
Мицеллообразование в неводных средах, как правило, является результатом действия сил притяжения между полярными группами ПАВ и взаимодействия углеводородных радикалов с молекулами растворителя. Образующиеся мицеллы обращенного вида содержат внутри негидратированные или гидратированные полярные группы, окруженные слоем из углеводородных радикалов. Число ассоциации (от 3 до 40) значительно меньше, чем для водных растворов ПАВ. Как правило, оно растет с увеличением углеводородного радикала до определенного предела.
Критическая концентрация мицеллообразования
— важнейшая характеристика растворов ПАВ. Она зависит прежде всего от строения углеводородного радикала в молекуле ПАВ и характера полярной группы, наличия в растворе электролитов и неэлектролитов, температуры и других факторов. Факторы, влияющие на ККМ:
1) При увеличении длины углеводородного радикала повышается растворимость ПАВ и возрастает KKM. Разветвленность, непредельность и циклизация углеводородного радикала уменьшают склонность к мицеллообразованию и увеличивают KKM. Характер полярной группы

играет существенную роль при мицеллообразовании в водных и неводных средах.
2)Введение электролитов в водные растворы неионогенных ПАВ слабо влияет на KKM и размер мицеллы. Для ионогенных ПАВ это влияние существенно.
3)Введение неэлектролитов (органических растворителей) в водные растворы ПАВ также приводит к изменению KKM.
4)Температура
Методы определения KKM основаны на регистрации резкого изменения физикохимических свойств растворов ПАВ в зависимости от концентрации (например, поверхностного натяжения σ, мутности τ, эквивалентной электропроводности λ, осмотического давления π, показателя преломления n). На кривой зависимости свойство — состав в области KKM обычно появляется излом.
1)
Кондуктометр ический метод применяется для определения
KKM
ионогенных ПАВ.
2) Другой метод' определения KKM основан на измерении поверхностно
го натяжения водных растворов ПАВ, которое резко уменьшается с ростом концентрации вплоть до KKM, а затем остается постоянным.
3)Солюбилизация красителей и углеводородов в мицеллах позволяет определять KKM ионогенных
инеионогенных ПАВ как в водных, так и неводных растворах. При достижении в растворе ПАВ концентрации, соответствующей KKM, растворимость углеводородов и красителей резко увеличивается.
4)Измерение интенсивности светорассеяния при мицеллообразовании позволяет не только находить KKM по резкому увеличению наклона концентрационной кривой, но и опоеделять мицеллярную массу и числа ассоциации.
3. Найдите графически время половинной коагуляции и начальную концентрацию частиц по изменению общей концентрации частиц лиофобной дисперсной системы:
τ, с |
ν·1015, частиц/м3 |
7,0 |
24,2 |
13,3 |
19,9 |
20,2 |
16,7 |


Экзаменационный билет
№25
1.Потенциальная теория адсорбции
Поляни. |
Десорбционный |
потенциал. |
|
Характеристическая |
кривая |
адсорбции. |
|
Температурная инвариантность |
и афинность |
||
характеристических кривых.
Потенциальная теория Поляни была предложена для термодинамического описания полимолекулярной адсорбции. Она устанавливает связь величины адсорбции с изменением давления пара (газа) и с теплотами адсорбции, исходя из объема адсорбционного пространства. Наиболее удачно теория Поляни предсказывает зависимость величины адсорбции от температуры.
Модель адсорбции в теории Поляни предполагает, что адсорбат ведет себя термодинамически как однокомпонентная система, находящаяся в потенциальном поле поверхностных сил адсорбента, который химически инертен. Теория Поляни принимает, что в адсорбционном пространстве действуют только дисперсионные силы, которые, во-первых, аддитивны, во-вторых, не зависят от температуры.
Введено допущение, что |
практически |
все |
|
адсорбированное |
вещество |
находится |
на |
поверхности в жидком состоянии. Это допущение в большой мере соответствует состоянию адсорбата в порах пористых адсорбентов. Именно поэтому подход, используемый в теории Поляни, оказался более пригодным для описания адсорбции на пористых адсорбентах, в порах которых происходит конденсация паров.
За меру интенсивности адсорбционного взаимодействия принят адсорбционный потенциал
— работа переноса 1 моль пара, находящегося в равновесии с жидким адсорбатом в отсутствие адсорбента (давление ps) в равновесную с адсорбентом паровую фазу (давление р):
 .
.
Этот потенциал характеризует работу против действия адсорбционных сил. Каждой точке изотермы адсорбции соответствуют определенные значения А и p/ps, которые позволяют получить значения V и ε, т. е. найти зависимости адсорбционного потенциала от объема адсорбата на адсорбенте — потенциальную кривую адсорбции.
Так как дисперсионные силы не зависят от температуры, то от температуры не должна зависеть и форма потенциальной кривой адсорбции, что
экспериментально подтверждается во многих случаях. Экспериментальные точки при разных температурах ложатся на одну и ту же кривую ε = f(V), которую поэтому называют
характеристической кривой: , т. е. адсорбционный потенциал при постоянном объеме жидкого адсорбата на адсорбенте (постоянной степени объемного заполнения) не зависит от температуры (температурная инвариантность характеристической кривой).
, т. е. адсорбционный потенциал при постоянном объеме жидкого адсорбата на адсорбенте (постоянной степени объемного заполнения) не зависит от температуры (температурная инвариантность характеристической кривой).

Важная особенность потенциальных кривых адсорбции, заключается в том, что характеристические кривые для одного и того же адсорбента и разных адсорбатов при всех значениях объемов адсорбата в поверхностном слое находятся в постоянном соотношении β:
Коэффициент β был назван коэффициентом аффинности, Отсюда следует, что, зная характеристическую кривую для одного адсорбата и коэффициент аффинности для другого адсорбата по отношению к первому, можно вычислить изотерму адсорбции второго адсорбата на том же адсорбенте.
2. Природа сил притяжения и отталкивания между частицами в дисперсных системах. Уравнение для энергии притяжения между частицами. Константа Гамакера и ее физческий смысл. Анализ зависимости суммарной энергии взаимодействия частиц от расстояния между ними.
Рассмотрим зависимость от расстояния энергии притяжения частиц — молекулярной составляющей расклинивающего давления. Из сил Ван-дер-Ваальса наиболее универсальны и существенны лондоновские силы дисперсионного взаимодействия.
Энергия электростатического отталкивания
пластин равна  .
.
Для вывода уравнения энергии молекулярного притяжении между частицами воспользуемся уравнением энергии притяжения одной молекулы (атома) к поверхности адсорбента (в данном случае
частицы):  Приращение энергии молекулярного
Приращение энергии молекулярного
притяжения, отнесенное к единице площади, пропорционально приращению числа молекул (атомов) в цилиндре с основанием, равным единице площади, т. е. ndr:
После интегрирования получим:
Величина A12 в уравнении называется константой Гамакера. Она учитывает природу взаимодействующих тел. Эта константа
выражается в единицах энергии и имеет значение порядка 10-19 Дж.
Чем сильнее взаимодействует дисперсная фаза со средой, тем меньше константа Гамакера, это значит, что силы притяжения между частицами уменьшаются.
Для области малых потенциалов суммарная энергия взаимодействия равна
