
- •Общие представления о теориях строения дэс. Уравнение Пуассона-Больцмана для диффузной части дэс и его решение для случая слабозаряженных поверхностей. Уравнение Гуи-Чепмена.
- •Рассчитайте удельную поверхность адсорбента по изотерме адсорбции азота, используя уравнение бэт. Площадь, занимаемая молекулой азота в плотном монослое, составляет 16·10-20 м2.
- •Механизмы образования дэс. Соотношение между электрическим потенциалом и поверхностным натяжением (уравнение Липпмана). Электрокапиллярные кривые и определение параметров дэс.
- •В таблице приведены данные по адсорбции паров воды макропористым адсорбентом при комнатой температуре. Пользуясь уравнением Ленгмюра определите емкость адсорбционного монослоя:
- •Современная теория строения дэс (теория Штерна); роль специфической адсорбции, перезарядка поверхности. Примеры образования дэс. Строение мицеллы.
- •По результатам измерения адсорбции на активированном угле рассчитайте удельную поверхность адсорбента (величина адсорбции указана в расчете на азот при нормальных условиях):
- •Вывод уравнения для скорости осаждения частиц в гравитационном поле. Условия соблюдения закона Стокса. Седиментационный анализ, расчет и назначение кривых распределения частиц по размерам.
- •Седиментационно-диффузионное равновесие (гипсометрический закон). Вывод уравнения. Мера седиментационной устойчивости. Факторы, влияющие на седиментационную устойчивость дисперсных систем.
- •Экзаменационный билет № 9 Мономолекулярная адсорбция, форма изотермы адсорбции. Уравнение Генри. Основные положения теории Ленгмюра.
- •Лиофильные дисперсные системы. Классификация и общая характеристика пав. Термодинамика и механизм мицеллообразования. Строение мицелл пав в водных и углеводородных средах. Солюбилизация.
- •Лиофильные дисперсные системы. Истинно растворимые и коллоидные пав, их классификация. Мицеллообразование, строение мицелл, методы определения ккм. Факторы, влияющие на ккм.
- •Гидрозоль AgI получен добавлением 8 мл кi с концентрацией 0,05 моль/л к 10 мл раствора AgNo3 с концентрацией 0,02 моль/л. Напишите формулу мицеллы образовавшегося золя и объясните строение дэс.
- •Экзаменационный билет № 13 Потенциальная теория адсорбции Поляни. Адсорбционный потенциал. Характеристическая кривая адсорбции. Температурная инвариантность и афинность характеристических кривых.
- •Рассчитайте концентрацию частиц гидрозоля золота через 300 с от начала быстрой коагуляции, если начальная концентрация составляла 2·1015 частиц/м3; вязкость дисперсионной среды 10-3 Па·с при 25 ºС.
- •Ньютоновские жидкости, уравнения Ньютона и Пуазейля. Методы измерения вязкости. Уравнение Эйнштейна для вязкости дисперсных систем, границы применения.
- •Седиментационный анализ. Кривые распределения частиц по размерам, их расчет и назначение, седиментация в центробежном поле.
- •Используя данные по адсорбции этана на поверхности однородной графитированной сажи при постоянной степени заполнения, рассчитайте изостерическую теплоту адсорбции:
- •Седиментационно-диффузионное равновесие (гипсометрический закон). Вывод уравнения. Мера седиментационной устойчивости. Факторы, влияющие на седиментационную устойчивость дисперсных систем.
- •Рассчитайте разность уровней воды в двух сообщающихся капиллярах диаметрами 0,1 и 0,3 мм при 20 ºС. Поверхностное натяжение и плотность воды составляют соответственно 72,75 мДж/м2 и 0,998 г/см3.
- •Экзаменационный билет № 21 Мономолекулярная адсорбция, форма изотермы адсорбции, уравнение Генри. Основные положения теории Ленгмюра, вывод уравнения и его анализ, линейная форма уравнения Ленгмюра.
- •Строение двойного электрического слоя (дэс) по теории Штерна, перезарядка поверхности. Примеры образования дэс, строение мицеллы.
- •Лиофильные дисперсные системы. Классификация и общая характеристика пав. Термодинамика и механизм мицеллообразования. Строение мицелл пав в водных и углеводородных средах. Солюбилизация.
- •Рассчитайте работу адгезии и коэффициент растекания для системы вода-графит, если известно, что краевой угол равен 90 º, а поверхностное наятжение воды 72 мДж/м2.
- •Лиофильные дисперсные системы. Истинно растворимые и коллоидные пав, их классификация. Мицеллообразование, строение мицелл, методы определения ккм. Факторы, влияющие на ккм.
- •Найдите графически время половинной коагуляции и начальную концентрацию частиц по изменению общей концентрации частиц лиофобной дисперсной системы:
- •Экзаменационный билет № 25 Потенциальная теория адсорбции Поляни. Десорбционный потенциал. Характеристическая кривая адсорбции. Температурная инвариантность и афинность характеристических кривых.
- •Используя уравнение Дубинина-Радушкевича, рассчитайте объем микропор сажи на основе данных об адсорбции паров бензола (мольный объем бензола 88,8 см3/моль):
По результатам измерения адсорбции на активированном угле рассчитайте удельную поверхность адсорбента (величина адсорбции указана в расчете на азот при нормальных условиях):
|
P·10-2, Па |
А·103, м3/кг |
|
1,85 |
5,06 |
|
4,01 |
9,90 |
|
68,80 |
40,83 |

Экзаменационный билет № 5
Правило фаз Гиббса и дисперсность. Влияние кривизны поверхности (дисперсности) на внутреннее давление тел (вывод и анализ уравнения Лапласа). Капиллярные явления (уравнение Жюрена).
Дисперсность является самостоятельным и полноправным термодинамическим параметром системы, а для дисперсных систем правило фаз Гиббса принимает следующий вид:
![]()
F – количество степеней свободы, К – количество компонентов, Ф – количество фаз.
Р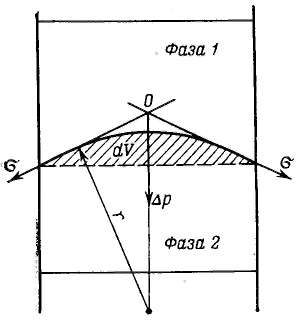 ассмотрим
результат влияния кривизны поверхности
раздела между двумя несмешивающимися
жидкостями на внутреннее давление в
фазах.
ассмотрим
результат влияния кривизны поверхности
раздела между двумя несмешивающимися
жидкостями на внутреннее давление в
фазах.
Кривизна вызывает
изменение площади и положения межфазной
поверхности, что можно выразить
приращением поверхностной энергии σds.
Кроме того, изменяются объемы фаз V1
и V2
на dV1
и dV2.
При условии постоянства объема всей
системы dV1
= - dV2.
Изменение объемов вызывает соответствующие
изменения энергий фаз 1 и 2 на p1dV1
и p2dV2
(где p1
и р2
— давления внутри фаз). Соотношение
между поверхностной энергией и «объемной»
можно записать с помощью обобщенного
уравнения первого и второго начал
термодинамики относительно энергии
Гельмгольца F
при T=const:
![]()
При равновесии
между фазами ΔF
= 0, тогда ![]()
Это уравнение называется уравнением Лапласа.
Для сферической
поверхности
![]() и уравнение принимает вид
и уравнение принимает вид![]() .
.
Капиллярные явления наблюдаются в содержащих жидкость узких сосудах (капилляры, капиллярно-пористые тела), у которых расстояние между стенками соизмеримо с радиусом кривизны поверхности жидкости. Кривизна возникает в результате взаимодействия жидкости со стенками сосуда (адгезия, смачивание). Специфика поведения жидкости в капиллярных сосудах зависит от того, смачивает или не смачивает жидкость стенки сосуда, точнее, от значения краевого угла.
Р ассмотрим
положение уровней жидкости в двух
капиллярах, один из которых имеет
лиофильную поверхность и поэтому стенки
его смачиваются, у другого внутренняя
поверхность лиофобизирована и не
смачивается. В первом капилляре
поверхность жидкости имеет отрицательную
кривизну, поэтому дополнительное
давление Лапласа стремится растянуть
жидкость (давление направлено к центру
кривизны) и поднимает ее в капилляре.
Кривизна поверхности жидкости во втором
капилляре положительна, дополнительное
давление направлено внутрь жидкости,
в результате жидкость в капилляре
опускается (отрицательное капиллярное
поднятие). При равновесии лапласовское
давление равно гидростатическому
давлению столба жидкости высотойh:
ассмотрим
положение уровней жидкости в двух
капиллярах, один из которых имеет
лиофильную поверхность и поэтому стенки
его смачиваются, у другого внутренняя
поверхность лиофобизирована и не
смачивается. В первом капилляре
поверхность жидкости имеет отрицательную
кривизну, поэтому дополнительное
давление Лапласа стремится растянуть
жидкость (давление направлено к центру
кривизны) и поднимает ее в капилляре.
Кривизна поверхности жидкости во втором
капилляре положительна, дополнительное
давление направлено внутрь жидкости,
в результате жидкость в капилляре
опускается (отрицательное капиллярное
поднятие). При равновесии лапласовское
давление равно гидростатическому
давлению столба жидкости высотойh:
![]()
![]()
Чтобы высоту капиллярного поднятия связать с характеристикой смачивания, радиус мениска необходимо выразить через угол смачивания θ и радиус капилляра r0. На рисунке показан мениск жидкости в капилляре. Видно, что r0 = r·соsθ, тогда высоту капиллярного поднятия можно представить в виде формулы Жюрена:
![]()

Нередко приходится наблюдать, как жидкость не может вытечь из капилляра под действием силы тяжести. Это объясняется проявлением действия капиллярного потенциала, направленного против силы тяжести, так как на нижнем конце капилляра жидкость образует мениск с положительной кривизной. Если часть капилляра, находящаяся над жидкостью, меньше высоты поднятия жидкости, жидкость из него не вытекает, так как кривизна мениска жидкости вверху капилляра становится положительной (положительный радиус кривизны), отвечающей гидростатическому давлению столба жидкости, равному размеру (высоте) капилляра, т. е. устанавливается равновесие.
