
- •Общие представления о теориях строения дэс. Уравнение Пуассона-Больцмана для диффузной части дэс и его решение для случая слабозаряженных поверхностей. Уравнение Гуи-Чепмена.
- •Рассчитайте удельную поверхность адсорбента по изотерме адсорбции азота, используя уравнение бэт. Площадь, занимаемая молекулой азота в плотном монослое, составляет 16·10-20 м2.
- •Механизмы образования дэс. Соотношение между электрическим потенциалом и поверхностным натяжением (уравнение Липпмана). Электрокапиллярные кривые и определение параметров дэс.
- •В таблице приведены данные по адсорбции паров воды макропористым адсорбентом при комнатой температуре. Пользуясь уравнением Ленгмюра определите емкость адсорбционного монослоя:
- •Современная теория строения дэс (теория Штерна); роль специфической адсорбции, перезарядка поверхности. Примеры образования дэс. Строение мицеллы.
- •По результатам измерения адсорбции на активированном угле рассчитайте удельную поверхность адсорбента (величина адсорбции указана в расчете на азот при нормальных условиях):
- •Вывод уравнения для скорости осаждения частиц в гравитационном поле. Условия соблюдения закона Стокса. Седиментационный анализ, расчет и назначение кривых распределения частиц по размерам.
- •Седиментационно-диффузионное равновесие (гипсометрический закон). Вывод уравнения. Мера седиментационной устойчивости. Факторы, влияющие на седиментационную устойчивость дисперсных систем.
- •Экзаменационный билет № 9 Мономолекулярная адсорбция, форма изотермы адсорбции. Уравнение Генри. Основные положения теории Ленгмюра.
- •Лиофильные дисперсные системы. Классификация и общая характеристика пав. Термодинамика и механизм мицеллообразования. Строение мицелл пав в водных и углеводородных средах. Солюбилизация.
- •Лиофильные дисперсные системы. Истинно растворимые и коллоидные пав, их классификация. Мицеллообразование, строение мицелл, методы определения ккм. Факторы, влияющие на ккм.
- •Гидрозоль AgI получен добавлением 8 мл кi с концентрацией 0,05 моль/л к 10 мл раствора AgNo3 с концентрацией 0,02 моль/л. Напишите формулу мицеллы образовавшегося золя и объясните строение дэс.
- •Экзаменационный билет № 13 Потенциальная теория адсорбции Поляни. Адсорбционный потенциал. Характеристическая кривая адсорбции. Температурная инвариантность и афинность характеристических кривых.
- •Рассчитайте концентрацию частиц гидрозоля золота через 300 с от начала быстрой коагуляции, если начальная концентрация составляла 2·1015 частиц/м3; вязкость дисперсионной среды 10-3 Па·с при 25 ºС.
- •Ньютоновские жидкости, уравнения Ньютона и Пуазейля. Методы измерения вязкости. Уравнение Эйнштейна для вязкости дисперсных систем, границы применения.
- •Седиментационный анализ. Кривые распределения частиц по размерам, их расчет и назначение, седиментация в центробежном поле.
- •Используя данные по адсорбции этана на поверхности однородной графитированной сажи при постоянной степени заполнения, рассчитайте изостерическую теплоту адсорбции:
- •Седиментационно-диффузионное равновесие (гипсометрический закон). Вывод уравнения. Мера седиментационной устойчивости. Факторы, влияющие на седиментационную устойчивость дисперсных систем.
- •Рассчитайте разность уровней воды в двух сообщающихся капиллярах диаметрами 0,1 и 0,3 мм при 20 ºС. Поверхностное натяжение и плотность воды составляют соответственно 72,75 мДж/м2 и 0,998 г/см3.
- •Экзаменационный билет № 21 Мономолекулярная адсорбция, форма изотермы адсорбции, уравнение Генри. Основные положения теории Ленгмюра, вывод уравнения и его анализ, линейная форма уравнения Ленгмюра.
- •Строение двойного электрического слоя (дэс) по теории Штерна, перезарядка поверхности. Примеры образования дэс, строение мицеллы.
- •Лиофильные дисперсные системы. Классификация и общая характеристика пав. Термодинамика и механизм мицеллообразования. Строение мицелл пав в водных и углеводородных средах. Солюбилизация.
- •Рассчитайте работу адгезии и коэффициент растекания для системы вода-графит, если известно, что краевой угол равен 90 º, а поверхностное наятжение воды 72 мДж/м2.
- •Лиофильные дисперсные системы. Истинно растворимые и коллоидные пав, их классификация. Мицеллообразование, строение мицелл, методы определения ккм. Факторы, влияющие на ккм.
- •Найдите графически время половинной коагуляции и начальную концентрацию частиц по изменению общей концентрации частиц лиофобной дисперсной системы:
- •Экзаменационный билет № 25 Потенциальная теория адсорбции Поляни. Десорбционный потенциал. Характеристическая кривая адсорбции. Температурная инвариантность и афинность характеристических кривых.
- •Используя уравнение Дубинина-Радушкевича, рассчитайте объем микропор сажи на основе данных об адсорбции паров бензола (мольный объем бензола 88,8 см3/моль):
Механизмы образования дэс. Соотношение между электрическим потенциалом и поверхностным натяжением (уравнение Липпмана). Электрокапиллярные кривые и определение параметров дэс.
Различают три возможных механизма образования двойного электрического слоя:
Двойной электрический слой образуется в результате перехода ионов или электронов из одной фазы в другую (поверхностная ионизация). Например, с поверхности металла в газовую фазу переходят электроны, создавая электронное облако со стороны газовой фазы.
Образование двойного электрического слоя происходит в результате адсорбции. Двойной электрический слой может образоваться при избирательной адсорбции в межфазном слое ионов электролитов, не входящих в состав веществ, образующих фазы, т. е. в результате адсорбции примесей.
Если вещества, составляющие фазы системы, не способны обмениваться зарядами, то двойной электрический слой может образоваться благодаря ориентированию полярных молекул сопряженных фаз в результате их взаимодействия.
Из объединенных первого и второго начал термодинамики, а также полного дифференциала энергии Гиббса выводится первое уравнение Липпмана, связывающее электрический потенциал с поверхностным натяжением:
![]()
Если знаки потенциала и заряда совпадают, то поверхностное натяжение снижается с ростом потенциала. Если же их знаки противоположны, то увеличение потенциала ведет к росту поверхностного натяжения. Эти зависимости тем сильнее,чем больше абсолютное значение плотности заряда. При минимальной плотности заряда поверхностное натяжение слабо зависит от потенциала.
Дифференциальная емкость двойного электрического слоя, как н любого конденсатора, определяется соотношением:
![]()
После дифференцирования первого уравнения Липмана по φ и подстановки в него данного соотношения получим второе уравнение Липпмана:
![]()
Это уравнение показывает возможность определения емкости двойного электрического слоя, если известна зависимость σ от φ.
![]()
Это уравнение называют уравнением электрокапиллярной кривой. Из него следует, что поверхностное натяжение при условии постоянства емкости двойного электрического слоя изменяется в соответствии с уравнением параболы.
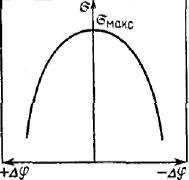
Вершина параболы отвечает максимальному поверхностному натяжению σмакс. Парабола симметрична, что по физическому смыслу означает равное сродство катионов и анионов, выступающих в роли противоионов, к поверхности, имеющей соответственно отрицательный и положительный потенциал. Уменьшение положительного потенциала, как и отрицательного, ведет к увеличению поверхностного натяжения. Однако в реальных системах емкость двойного электрического слоя несколько изменяется с изменением потенциала, и поэтому экспериментальные электрокапиллярные кривые обычно не являются симметричными.
Вершина параболы соответствует точке нулевого заряда. В этой точке поверхностное натяжение не зависит от потенциала, так как производная dσ/dφ равна нулю, т. е. поверхностный слой имеет нулевой заряд, что означает отсутствие двойного электрического слоя. Потенциал же поверхности в этой, точке не равен нулю.
