
Khimia_Polny_spravochnik_dlya_podgotovki_k_EGE
.pdf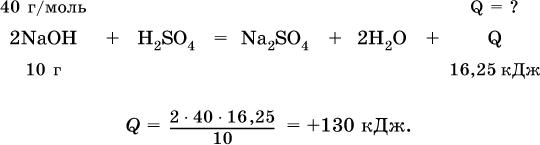
серной кислотой (конц.) вступило O,5 моль фторида кальция.
10.Сероводород (4,48 л при н.у.) смешали с избытком диоксида серы. Какова масса (в граммах) твердого продукта этой реакции?
11.Поглощение 5,6 л (н.у.) сероводорода раствором нитрата висмута (III) приводит к выпадению осадка средней соли. Найдите массу (в граммах) этого осадка.
12.Раствор гидроксида цезия поглотил 17,92 л (н.у.) диоксида серы с образованием средней соли. Вычислите массу (в граммах) щелочи, истраченной на реакцию.
13.Прокалили 99,3 г нитрата свинца (II). Определите суммарный объем (в литрах, н.у.) полученных газов.
14.В избыток воды внесено 3,75 моль оксида фосфора (V). Какая масса (в граммах) продукта образовалась?
15.Прокаливанием 192 г карбоната аммония получена смесь двух газов и вода. Установите общий объем (в литрах, н.у.) смеси.
16.Внесено 14 г аморфного кремния в концентрированный раствор едкого натра. Рассчитайте объем (в литрах, н.у.) собранного газа.
17.Какой объем в литрах (н.у.) хлора потребуется для получения из метана 4 моль
хлороформа?
18.Найдите количество бромэтана (моль), вступившее в реакцию с натрием, если образовалось 237 л (н.у.) органического продукта.
19.Ацетилен обесцвечивает бромную воду с образованием 3,46 г конечного продукта. Определите объем (мл, н.у.) затраченного алкина.
20.Каталитическая реакция дегидрирования 49 г метилциклогексана приводит к получению гомолога бензола. Вычислите объем (в литрах, н.у.) образовавшегося одновременно газа.
21.Этанол с плотностью 0,8 г/мл затрачен на получение 44,8 л (н.у.) дивинила. Установите расход (мл) спирта.
22.На восстановление 10 кмоль этаналя в соответствующий спирт используют водород. Найдите его затраченный объем (м3, н.у.).
23.Рассчитайте объем (в литрах, н.у.) газа, полученного при спиртовом брожении 5 моль глюкозы.
24.При сгорании природной аминокислоты (с одной группой NH2 в молекуле) в кислороде получена смесь N2 + СO2 общим объемом 0,56 л (н.у.) и плотностью по водороду 20,4. Определите массу (мг) взятой кислоты.
15.4.Тепловой эффект реакции
Пример решения задачи части В
Вычислите тепловой эффект (кДж) реакции полной нейтрализации гидроксида натрия серной кислотой, если в расчете на 10 г щелочи выделяется 16,25 кДж теплоты.
Задания для самостоятельного решения части А
1.В реакции между железом и хлором на 11,2 л (н.у.) окислителя приходится выделение 132 кДж теплоты, следовательно, в расчете на 0,5 моль железа выделится количество теплоты (кДж), равное
1) +198
2) +148,5
3) +99
4) +49,5
2.Триоксид серы массой 280 г вносят в воду, протекает реакция с тепловым эффектом +73 кДж. Количество теплоты (кДж) в условиях опыта равно
1) +204,4
2) +255,5
3) +408,8
4) +511
3.Термическое разложение нитрата калия привело к выделению 4,48 л (н.у.) газа. Тепловой эффект реакции равен -282 кДж, следовательно, сопровождающее процесс количество теплоты (кДж) составляет
1) -56,4
2) -112,8
3) -225,6
4) -282
4.Сожжено 10 л (н.у.) аммиака на воздухе (тепловой эффект реакции +1532 кДж). По условию опыта количество теплоты составит
1) +171
2) +342
3) +766
4) +855
5.Термическое разложение карбоната кальция с тепловым эффектом -179 кДж привело
кполучению 33,6 г твердого остатка. В этих условиях поглощенное количество теплоты (кДж) равно
1) -537
2) -214,8
3) -375,9
4) -107,4
6.При термическом разложении дихромата аммония протекает экзотермическая реакция, в которой на 1,4 моль образовавшейся воды приходится +106 кДж; следовательно тепловой эффект реакции (кДж) равен:
1) +505
2) +404
3) +303
4) +606
7.Реакция сгорания угарного газа в кислороде сопровождается экзо-эффектом +566 кДж. Количество теплоты (кДж), приходящееся на 224 г угарного газа, равно
1) +1132
2) +2264
3) +283
4) +566
8.Тепловой эффект реакции полного сгорания ацетилена в кислороде равен +2596 кДж. При сгорании 2 л (н.у.) этого газа выделяется количество теплоты (кДж)
1) +29
2) +58
3) +116
4) +232
9.В термическом разложении метана с образованием ацетилена и 560 л (н.у.) водорода тепловой эффект реакции равен -376 кДж. Количество поглощенной теплоты (кДж) в условиях опыта составляет
1) -2256
2) -752
3) -1128
4) -376
10.При полном сгорании бутадиена-1,3 в кислороде на 0,5 моль затраченного окислителя выделяется +18 кДж теплоты, следовательно, на 0,5 моль вступившего в реакцию алкадиена приходится количество теплоты (кДж), равное
1) +49,5
2) +99
3) +148,5
4) +198
15.5. Масса (объем, количество вещества) продукта по реагенту в избытке или с примесями
Избыток и недостаток реагентов. Количества, массы и объемы (для газов) реагентов не всегда берутся стехиометрическими, т. е. в соответствии с уравнениями реакции. Чаще один из реагентов берется в избытке, а следовательно, другой реагент оказывается в недостатке. Избыток реагента участвовать в реакции не будет.
Для реакции aA + bB = cC + dD определение реагентов, взятых в избыткеи в недостатке, проводят по неравенству (А – в недостатке, В – в избытке):
где n(общ. В) – общее (взятое с избытком) количество реагента В, пB – стехиометрическое (необходимое для реакции) количество В, n(изб. В) – избыточное количество В, причем
n(изб. B) = n(общ. B) – nB.
Внимание! Расчет получаемых количеств (масс, объемов) продуктов проводят по реагенту в недостатке.
Степень чистоты вещества. Химические вещества никогда не бывают идеально чистыми, они всегда содержат в себе примеси.
Массовая доля вещества В в смеси, например А + В + С, – это отношение массы вещества В к массе смеси:

Сумма массовых долей всех веществ смеси равна 1 (100 %).
Если в смеси примесь присутствует в следовом (неопределяемом) количестве, то говорят о практически чистом веществе. Когда же в веществе имеется примесь в заметном (определяемом) количестве, то само вещество называют основным (его количество преобладает), а другое вещество – это и есть примесь.
Степень чистоты основного вещества В – это массовая доля этого вещества в навеске с определенной массой:
Природные вещества (минералы, руды) всегда содержат заметное количество примеси (примесей).
Пример решения задачи
Углекислый газ поглощается 10 %-ным раствором аммиака (плотность раствора 957 г/л) с образованием кислой соли. Предварительно СO2 получают термическим разложением 5 кг известняка СаСO3 (степень чистоты 60 %). Установите взятый объем (в литрах) раствора аммиака. Элементы ответа.
1)Составлены уравнения реакций:
2)Установлено количество основного вещества в известняке:
и количество углекислого газа по уравнению (I):
3)Установлена масса затраченного аммиака по уравнению (II):
4)Установлен объем взятого раствора аммиака:
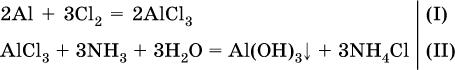
Задания для самостоятельного решения частей В, С
1.К 100 г 10 %-ного раствора хлорида кальция добавили 100 г 10 % – ного раствора AgNO3. Найдите массу (в граммах) осадка.
2.Смешали горячие растворы, содержащие по 33 г хлорида алюминия и сульфида калия. Установите объем (в литрах, н.у.) выделившегося газа.
3.Какой объем (в литрах, н.у.) хлора можно получить при взаимодействии 2 моль хлороводорода (взят в виде соляной кислоты) и 3 моль оксида марганца(IV)?
4.Через раствор, приготовленный из 2 г смеси NaCl + Nal и 100 мл воды, пропустили 1
л(н.у.) хлора. Затем раствор выпарили и сухой остаток нагрели. Получили 1,78 г твердого вещества. Рассчитайте массовую долю (в %) хлорида в исходном растворе.
5.Вычислите объем (в литрах, н.у.) газа, полученного действием кипящей H2SO4 (конц.) на 292,5 г хлорида натрия, содержащего 2O% инертных примесей.
6.После прокаливания 50 г минерала тенорит (CuО и инертные примеси) в токе водорода образуется металл и конденсируется вода объемом 8,1 мл. Определите степень чистоты (в %) этого минерала.
7.Установите массу (кг) технического алюминия (степень чистоты 98 %), требуемую для получения 64,22 кг хрома из оксида хрома (III).
8.Прокалили 32,1 г хлорида аммония с 55,5 г гидроксида кальция (содержит 20 % инертных примесей). Рассчитайте объем (в литрах, н.у.) собранного газа.
9.К 285 г нитрата натрия (содержит примесь хлорида магния) добавили раствор избытка нитрата серебра (I). Выпал осадок массой 86,1 г. Вычислите степень чистоты (в %) нитрата натрия.
10.Найдите массовую долю (в %) примеси NaHCO3 в образце технической соды Na2CO3, если после нагревания 10 г образца получено 9,69 г твердого остатка.
11.Смешали 20 г уксусной кислоты и 8,4 г питьевой соды NaHCO3. Определите объем (в литрах, н.у.) газа, собранного после окончания реакции.
12.На гидрирование 250 г смеси Cl7Н33СООН + Cl7Н35СООН затратили 16,8 л (н.у.) газа. Установите массовую долю (в %) предельной карбоновой кислоты в исходной смеси.
15.6. Масса (объем, количество вещества) продукта по реагенту с известной массовой долей в растворе
Пример решения задачи
Навеску алюминия массой 13,7 г полностью сожгли в хлоре, а из образовавшейся соли приготовили 250 мл раствора. Пробу в 50 мл этого раствора слили с 68,4 мл 10,4 %-ного раствора аммиака (плотность раствора 0,956 г/мл). Определите массу (в граммах) выпавшего осадка.
Элементы ответа.
1)Составлены уравнения реакций:
2)Определены количества AlCl3 в реакциях (I) и (II): в реакции (I)

в реакции (II) взята 1/5 часть AlCl3, т. к.
отсюда
3) Определено количество NH3 в растворе для реакции (II):
следовательно, NH3 – в избытке, и расчет далее ведется по AlCl3.
4) Определена масса Al(ОН)3 по уравнению (II): 0,1014 моль AlCl3 – 0,1014 моль
Al(ОН)3,
Задания для самостоятельного решения частей В, С
1.Приготовили раствор 134,4 л (н.у.) диоксида серы и добавили 1,5 л 25 %-ного раствора гидроксида натрия (плотность раствора 1,28 г/мл). Определите массу (в граммах) образовавшейся соли.
2.Сульфид свинца (II) массой 95,6 г обрабатывают с помощью 300 мл 30 %-ного раствора пероксида водорода (плотность раствора 1122,2 г/л). Рассчитайте массу (в граммах) продукта – сульфата свинца (II).
3.Смешали 100 г 5,64 %-ного раствора фенола и 100 г 17,92 %-ного раствора гидроксида калия. Найдите массовую долю (в %) избытка одного из реагентов в конечном растворе.
4.Установите массу (в граммах) железной пластинки после выдерживания в 110 мл
10 %-го раствора CuSO4 (плотность раствора 1,1 г/мл), если до опыта ее масса составляла
11,5 г.
5.Вычислите объем (в литрах) 96 %-ного водного спирта с плотностью 0,81 кг/л, полученного каталитической гидратацией 112 м3 (н.у.) этилена, содержащего 12,5 % (по объему) этана.
6.Газ, полученный сжиганием 44,8 л (н.у.) сероводорода в кислороде, поглощен с помощью 0,5 л 25 %-ного раствора гидроксида натрия (плотность раствора 1,275 г/ мл). Определите массовую долю (в %) соли в конечном растворе.
7.Углекислый газ объемом 15 л (н.у.) пропущен через 560 г 5%-ного раствора гидроксида калия. Найдите массу (в граммах) соли, полученной в этом процессе.
8.Железная пластинка массой 5 г опущена на некоторое время в 50 мл 15 %-ного раствора сульфата меди (II) с плотностью 1,12 г/мл. Масса пластинки увеличилась на 0,16 г.
Какова массовая доля (в %) сульфата меди (II) в оставшемся растворе?
9.По реакции Кучерова получен этаналь, который переведен в соответствующую кислоту в виде 100 г 6%-ного водного раствора. Найдите объем (в литрах, н.у.) исходного органического соединения в получении этаналя.
10.Определите массовую долю (в %) избытка одного из реагентов в растворе после сливания 80 г 10 %-ного раствора гидроксида натрия и 2O г 18,25 %-ной хлороводородной кислоты.
11.Установите объем (в литрах, н.у.) газа, собранного после внесения 0,3 моль алюминия в 160 мл 20 %-ного раствора гидроксида калия (плотность раствора 1,19 г/мл).
12.Найдите массу (в граммах) органического продукта, полученного при смешивании 250 г 94 % – ного водного раствора фенола и 2143 г 3,5 %-ной бромной воды.
15.7. Нахождение молекулярной формулы органического соединения
При выведении формул веществ, особенно в органической химии, часто используют относительную плотность газа.
Относительная плотность газа X – отношение абсолютной плотности этого (неизвестного) газа к абсолютной плотности другого (известного) газа В при одинаковых условиях:
Для 1 моль газа его абсолютная плотность равна
откуда
Если газ В задан, то
–плотность газа X по водороду Н2 (М = 2 г/моль)
–плотность газа X по воздуху (М = 29 г/моль)
и аналогично для любого другого известного газа X.
Примеры решения задач
1. В результате сгорания кислородсодержащего органического соединения в избытке воздуха собрано 1,584 г СO2 и O,972 мл Н2O. Плотность пара этого соединения по воздуху равна 1,5865.
Выведите формулу соединения, если в его молекуле содержатся два одноименных радикала.
Элементы ответа.
1) Составлена схема реакции:

2) Определена масса С и Н в этом соединении:
3) Определена формула соединения CxНyOz:
при х = 1 и у = 3: М(СН3) = 15, 46–15 = 31 г/моль на кислород – это не подходит, при х = 2 и у = 6: 2М(СН3) = 30, М0 = 16, 30 + 16 = = 46 г/моль – это подходит, таким
образом, искомая формула соединения С2Н6O, или с учетом условия (СН3)2O.
2. Некоторая масса неизвестного алкина с избытком хлора дает 21 г тетрахлор-производного. Такая же масса того же алкина с избытком брома – 38,8 г тетрабром-производного. Выведите формулу взятого алкина.
Элементы ответа.
1)Составлены уравнения реакций:
2)Составлены выражения для молярных масс производных:
и для молярной массы алкина:
3) Выведена формула алкина: по условию масса алкина одинакова в реакциях (I) и (II), следовательно
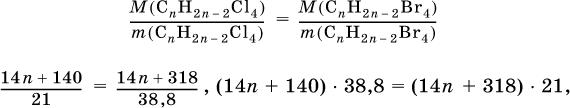
откуда n = 5 и формула алкина С5Н8.
Задания для самостоятельного решения части С
1.При сжигании углеводорода (плотность по воздуху равна 2) в кислороде образовалось 90 г воды. Выведите формулу углеводорода.
2.Гомолог этена массой 7 г присоединяет 2,24 л (н.у.) бромоводорода. Какова формула этого гомолога?
3.Выведите формулу некоторого углеводорода, если при сжигании в кислороде он образовал 6,6 г углекислого газа и 2,16 мл воды.
4.При полном сгорании некоторого арена в кислороде собрано 7,168 л (н.у.) углекислого газа. Выведите формулу этого углеводорода.
5.Выведите формулу одноатомного спирта, если при взаимодействии 27,6 г этого спирта с бромоводородом (в присутствии серной кислоты) получено 65,4 г бромалкана.
6.При сжигании 1,64 г органического соединения в избытке кислорода получено 1,06 г карбоната натрия, 1,12 л (н.у.) углекислого газа и 1,26 мл воды. Выведите формулу этого соединения.
7.Выведите формулу двухатомного спирта, при взаимодействии 9,3 г которого с кальцием собрано 3,36 л (н.у.) газа.
8.К 14 г смеси фенола и 0,05 моль гомолога бензола добавили бромную воду и получили 33,1 г осадка. Выведите формулу гомолога бензола.
9.После сжигания в кислороде навески соединения класса фенолов образуются 16,8 л (н.у.) углекислого газа и 6,75 мл воды. Выведите формулу этого соединения (плотность по воздуху 3,793).
10.В реакции «серебряного зеркала» с участием 9,9 г альдегида выпадает 48,6 г осадка. Выведите формулу альдегида.
11.При взаимодействии 71,15 мл 30 %-ного раствора одноосновной карбоновой кислоты (плотность раствора 1,04 г/мл) с избытком гидрокарбоната натрия выделилось 6,72
л(н.у.) газа. Выведите формулу этой кислоты.
12.При сжигании на воздухе 3,84 г соли одноосновной карбоновой кислоты получено 2,24 л (н.у.) углекислого газа, 1,8 мл воды и 2,12 г карбоната натрия. Выведите формулу этой соли.
13.Соль серебра (I) и одноосновной карбоновой кислоты обработана избытком хлора. Образовались монохлорпроизводное углеводорода, углекислый газ и осадок хлорида серебра
(I). Плотность пара хлорпроизводного по воздуху равна 3,19. Выведите формулу исходной соли.
14.Одноосновная карбоновая кислота полностью прореагировала с 3,2 мл метанола (плотность 0,8 г/мл) и дала 8,16 г органического продукта. Какова формула этого продукта?
15.Выведите формулу этилового эфира одноосновной карбоновой кислоты, если при омылении 14,8 г этого эфира с помощью едкого натра получено 9,2 г этанола.
16.При сжигании 13,5 г кислородсодержащего органического соединения образовалось 19,8 г углекислого газа и 8,1 мл воды. При этом выделилось 210 кДж теплоты. Выведите формулу соединения, если тепловой эффект реакции 2800 кДж.
17.При полном сгорании 22,5 г некоторой α-аминокислоты в кислороде собрано 13,44
л(н.у.) углекислого газа и 3,36 л (н.у.) азота. Выведите формулу кислоты.
18. После щелочного гидролиза метилового эфира природной моноаминокарбоновой кислоты получено 200 г раствора, в котором массовые доли спирта и натриевой соли аминокислоты равны соответственно 3,2 % и 11,1 %. Выведите формулу исходного эфира.
Ответы
Раздел 1
1. 2. 2. 2. 3. 3. 4. 3. 5. 2. 6. 3. 7. 3.
Раздел 2
1. 3. 2. 2. 3. 2. 4. 4. 5. 3. 6. 1. 7. 2. 8. 1. 9. 4. 10. 2. 11. 3. 12. 2. 13. 2. 14. А-2, Б-4, В-6, Г-3.
Раздел 3
1. 4. 2. 4. 3. 3. 4. 2. 5. 1, 4. 6. 2, 4. 7. 2. 8. 3. 9. 3. 10. 3. 11. 4. 12. 1. 13. 2.
Раздел 4
1.1, 4. 2. 4. 3. 4. 4. 2. 5. 3. 6. 2. 7. 2. 8. 3. 9. 2. 10. 4. 11. 2. 12. 3. 13. 1. 14. 4. 15. 1. 16. 4. 17.
1.18. 1, 4. 19. 3. 20. А-4, Б-2, В-5, Г-3. 21. А-3, Б-5, В-4, Г-1. 22. 2. 23. См. разделы 6.3, 7.3.2,
7.3.4.24. См. разделы 4, 5.3, 6.3, 7.4.2.
Раздел 5
1. 1. 2. 2, 4. 3. 2, 4. 4. 3. 5. 1, 3. 6. 3. 7. 2. 8. 4. 9. 2.
Раздел 6
