
- •2.Трансферты
- •3.Гидролазы
- •4. Лиазы
- •5. Изомеразы
- •6. Лигазы (синтетазы)
- •Обратимое ингибирование Конкурентное ингибирование
- •Неконкурентное ингибирование
- •Ингибирование субстратом
- •3. Водорастворимые витамины
- •Антистрессовое и противошоковое действие
- •1. Причины, приводящие к увеличению количества ферментов в крови
- •2. Изоферменты
2. Изоферменты
Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изофермен-тами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента.
Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов.
По своей структуре изоферменты в основном являются олигомерными белками. Причём та или иная ткань преимущественно синтезирует определённые виды протомеров. В результате определённой комбинации этих протомеров формируются ферменты с различной структурой - изомерные формы. Обнаружение определённых изоферментных форм ферментов позволяет использовать их для диагностики заболеваний.
Изоформы лактатдегидрогеназы. Фермент лак-татдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты) (см. раздел 7).
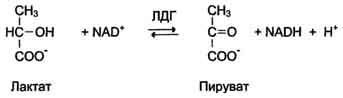
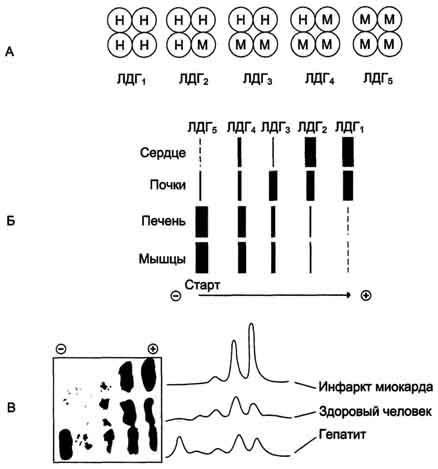
Лактатдегидрогеназа - олигомерный белок с молекулярной массой 134 000 Д, состоящий из 4 субъединиц 2 типов: М (от англ, muscle - мышца) и Н (от англ, heart - сердце). Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы (рис. 2-35, А). ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента.
Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ (рис. 2-35, Б).
120
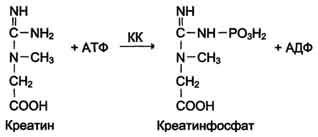
Изоформы креатинкиназы. Креатинкиназа (КК) катализирует реакцию образования креатинфосфата:
121
Молекула КК - димер, состоящий из субъединиц двух типов: М (от англ, muscle - мышца) и В (от англ, brain - мозг). Из этих субъединиц образуются 3 изофермента - ВВ, MB, MM. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и MB - в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность (рис. 2-36).
Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
Изоферменты — это ферменты, синтез которых кодируется разными генами, у них разная первичная структура и разные свойства, но они катализируют одну и ту же реакцию. Виды изоферментов:
Органные — ферменты гликолиза в печени и мышцах.
Клеточные — малатдегидрогеназа цитоплазматическая и митохондриальная (ферменты разные, но катализируют одну и ту же реакцию).
Гибридные — ферменты с четвертичной структурой, образуются в результате нековалентного связывания отдельных субъединиц (лактатдегидрогеназа — 4 субъединицы 2 типов).
Мутантные — образуются в результате единичной мутации гена.
Аллоферменты — кодируются разными аллелями одного и того же гена.
10. I. Применение ферментов с лечебной целью в свою очередь подразделяется на два вида: 1) применение в целях заместительной терапии и 2) с целью воздействия фермента на очаг заболевания.
С целью заместительной терапии наиболее широко используют пищеварительные ферменты, когда у пациента обнаруживается их недостаточность. В качестве примера можно привести препараты желудочного сока или чистыйпепсин или ацидин-пепсин, который незаменим при гастритах с секреторной недостаточностью, при диспепсиях у детей. Панкреатин - препарат, представляющий смесь ферментов поджелудочной железы, применяют при панкреатитах, в основном хронического характера. Такое же значение имеют известные препараты холензим, панзинорм и др.
Другая область применения заместительной терапии - это лечение заболеваний, связанных с так называемымиэнзимопатиями. Это заболевания врожденные или наследственные, при которых нарушен синтез каких-либо ферментов. Эти заболевания обычно чрезвычайно тяжелые, дети с наследственным отсутствием какого-либо фермента живут недолго, страдают тяжелыми умственными и расстройствами, отсталостью физического и умственного развития. Заместительная терапия иногда может помочь преодолеть эти нарушения.
Целый ряд ферментных препаратов используют в хирургической практике для очистки раневой поверхности от гноя, микробов, излишков грануляционной ткани; в клинике внутренних болезней их применяют:с целью разжижения вязких секретов, экссудатов, сгустков крови, например, при тяжелых воспалительных заболеваниях легких и бронхов. это в основном ферменты - гидролазы, способные расщеплять природные биополимеры - белки, НК, полисахариды. В связи с их противовоспалительным действием их применяют также при тромбофлебитах, воспалительно-дистрофических формах пародонтоза, остеомиелите, гайморите, отитах и др. воспалительных заболеваниях.
Среди них такие ферменты, как трипсин, химотрипсин, РНК-за, ДНК -аза, фибринолизин. Фибиринолизин также используют для удаления внутрисосудистых тромбов. РНК-азу и ДНК-азу с успехом применяют для лечения некоторых вирусных инфекций, например для уничтожения вируса герпеса.
Такие ферменты, как гиалуронидаза, коллагеназа, лидаза, используются для борьбы с излишними рубцовыми образованиями.
Аспарагиназа - фермент, образуемый некоторыми штаммами кишечной палочки. Оказывает лечебный эффект при некоторых формах опухолей. Лечебный эффект связан со свойством фермента нарушать обмен аминокислоты аспарагина, необходимой опухолевым клеткам для роста.
Применение ферментных препаратов с лечебной целью представляет пока еще очень молодое направление медицинской науки. Ограничением здесь является трудоемкость технологий и дороговизна получения чистых ферментных препаратов в кристаллическом виде, пригодном для хранения и применения у человека. Кроме того, при использовании ферментных препаратов приходится учитывать также и другие обстоятельства:
1) Ферменты - это белки, а следовательно в некоторых случаях могут вызвать нежелательную аллергическую реакцию.
2) Быстрым разложением введенных ферментов (белковый препарат, поэтому немедленно захватывается клетками "мусорщиками" - макрофагами, фибробластами и др. Отсюда, требуются большие концентрации препаратов, чтобы достичь нужного эффекта.
3) Однако при повышении концентрации ферментные препараты могут оказаться токсичными.
И все-таки, в тех случаях, когда удается преодолеть эти препятствия, ферментные препараты оказывают прекрасный лечебный эффект.
Например, эти недостатки частично устраняются при переводе ферментов в так называемую "иммобилизованную" форму.
Более подробно о методах иммобилизации ферментов и способах их применения вы прочтете в ваших учебно-методических пособиях.
