
Химия_Лабораторный практикум
.pdf
Наблюдения и выводы
1. По полученным данным построить график t =f (τ), откладывая на оси абсцисс время τ (мин), а на оси ординат температуру t (oC), например, как на рисунке 3.2а.
Весь калориметрический процесс делится на три периода:
1)предварительный;
2)главный — процесс растворения соли;
3)заключительный.
После внесения всех опытных данных при экзотермическом растворении на графике получается кривая АВДЕ, где АВ — предварительный период, ВД — главный, ДЕ — заключительный. Время главного периода разделить пополам (точка С). Из точки С восстановить перпендикуляр и произвести экстраполяцию прямолинейных участков АВ и ДЕ на этот перпендикуляр. Отрезок между точками КF, выраженный в градусах, есть изменение температуры ∆t, вызванное процессом. Аналогично строится график при эндотермическом растворении соли (рисунок 3.2 б).
Рисунок 3.2 — Графический метод определения изменения температуры во время калориметрического опыта:
а– экзотермическое растворение; б – эндотермическое растворение
2.На основании полученных данных рассчитать количество теплоты Q, выделившейся или поглощенной в калориметре в процессе растворения соли
Q = [Ccт. mcт. + Ср-ра (mН2О + mcоли)]· ∆t, |
(3.7) |
где mcт. — масса стеклянных частей прибора, г;
Ccт. — удельная теплоемкость стекла, равная 0,753 Дж/(г · К); mН2О — масса воды, г;
21
mсоли — масса соли,г;
Ср-ра — удельную теплоемкость раствора считать равной
4,18 Дж/(г·К);
∆t — изменение температуры при растворении соли.
3. Рассчитать стандартную теплоту растворения соли ∆раст. Но (298 К) по формуле, кДж/моль:
растH2980 = − |
Q Mсоли |
; |
(3.8) |
|
mсоли 1000 |
||||
|
|
|
где Мсоли – молярная масса соли, г/моль.
4. Полученный результат сравнить с теоретически рассчитанным значением ∆раст.Но298 соли и рассчитать абсолютную и относительную ошибки опыта.
Опыт 2. Определение теплоты гидратообразования сульфата меди (II)
Выполнение опыта
По методике, предложенной в опыте 1, определить ∆rHo298 (1) реакции (3.3) и ∆rHo298 (2) реакции (3.4) и рассчитать теплоту гидратообразования СuSO4. Для проведения опыта получить две навески: первую — 7,5 г СuSO4·5Н2О, вторую — 4,5 г безводной соли СuSO4.
Для растворения безводной соли СuSO4 отмерить цилиндром 300 см3 воды, а для растворения навески 7,5 г СuSO4·5Н2О — 297 см3. Разница в 3 г соответствует количеству воды, которое содержится в 7,5 г кристаллогидрата.
Наблюдения и выводы
Методика расчета теплот растворения безводной соли и кристаллогидрата аналогична рассмотренной в опыте 1.
Рассчитать теоретическое значение ∆r Ho298 (3) по справочным данным и сравнить его с опытным. Определить относительную ошибку опыта.
22
Лабораторная работа № 4
ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Цель работы:
1)установить влияние концентрации реагирующих веществ на скорость химической реакции;
2)определить влияние концентраций исходных и конечных веществ на смещение равновесия обратимой реакции.
Контрольные вопросы к лабораторной работе
1.Какие реакции называются гомогенными и гетерогенными?
2.Что называется скоростью химической реакции и от каких факторов она зависит?
3.Как формулируется и математически записывается закон действия масс для гомогенных реакций?
4.Каковы особенности применения закона действия масс для гетерогенных реакций?
5.Каков физический смысл константы скорости химической реакции и от каких факторов она зависит?
6.Как формулируется и математически записывается правило Вант-Гоффа?
7.Дайте определение температурного коэффициента ВантГоффа.
8.Какие молекулы называются активными и что такое энергия активации?
9.Какое состояние химической реакции называется равновесным?
10.Что характеризует константа равновесия и от каких факторов она зависит?
11.Сформулируйте принцип, который определяет направление смещения равновесия химической реакции.
Теоретическая часть
Химическая кинетика — учение о скорости химических реакций и равновесии. Знание законов химической кинетики позволяет управлять процессами, имеющими место в самых разнообразных сферах производства: горением топлива, электролитическими реакциями, коррозией металлов, биоорганическими процессами и др.
Скорость химической реакции определяется числом взаимодействий в единицу времени в единице объема (для гомогенных реак-
23
ций) или на единице поверхности раздела фаз веществ для реакций, протекающих в гетерогенной системе.
Размерность скорости гомогенной реакции — моль/(л·с), гетерогенной — моль/(см2 · с).
Скорость химической реакции зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализатора и т. д. Для реакций с участием твердых веществ скорость реакции зависит также и от степени измельчения, а для газов — от давления.
Скорость реакции, протекающей при постоянной температуре в гомогенной среде, прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов согласно закону действия масс. Так,
для реакции, идущей в одну стадию и записанной в общем виде |
|
m A(г) + n B(г) = p C(г) + q D(г) |
(4.1) |
закон действующих масс имеет следующее выражение: |
|
υ = k CAm · CBn, |
(4.2) |
где υ — скорость прямой химической реакции; k — константа скорости реакции;
CA и CB — концентрации реагирующих веществ А и В;
m и n — стехиометрические коэффициенты реагирующих веществ А и В.
При гетерогенных реакциях концентрации веществ, находящихся в твердой фазе, обычно не изменяются в ходе реакции, поэтому их не включают в уравнение закона действующих масс.
Скорость химической реакции определяется путем изменения концентраций веществ, участвующих в лимитирующей стадии процесса (если реакция протекает в несколько стадий).
Химическое равновесие — это такое состояние системы, при котором скорости прямой и обратной реакций равны. Для обратимой гомогенной реакции:
mA + nB ↔ pC + gD
константа химического равновесия:
|
C p C q |
|
|
KC = |
C D |
. |
(4.3) |
|
|||
|
CAm CBn |
|
|
|
24 |
|
|

Вобратимых химических реакциях равновесие устанавливается
втот момент, когда отношение произведения концентраций продуктов, возведенных в степени их стехиометрических коэффициентов, к произведению концентраций исходных веществ, также возведенных в соответствующие степени, равно некоторой постоянной величине, называемой константой равновесия.
Константа химического равновесия зависит от природы реагирующих веществ и от температуры. Концентрации реагирующих веществ, при которых устанавливается равновесие, называются равновесными. Чем больше значение константы равновесия химической реакции, тем больше выход ее продуктов.
Изменение внешних условий (концентрации, температуры, давления) вызывает смещение химического равновесия и переход в новое равновесное состояние. Направление смещения химического равновесия определяется принципом Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, производить какое-либо внешнее воздействие (изменять температуру, давление, концентрацию), то в этой системе самопроизвольно возникают процессы, стремящиеся ослабить произведенное воздействие.
Экспериментальная часть
Опыт 1. Влияние концентрации реагирующих веществ на скорость химической реакции в гомогенной системе
Взаимодействие тиосульфата натрия с серной кислотой протекает по уравнению:
Na2S2O3(aq) + H2SO4(aq) = Na2SO4(aq) + S(тв) + SO2 (г) +H2O(ж). (4.4)
Выполнение опыта
Предварительно проделать качественный опыт: в пробирку налить 5–10 капель 1 н. раствора тиосульфата натрия Na2S2O3 и добавить 1–2 капли 2 н. раствора серной кислоты. Наблюдать появление слабой опалесценции и дальнейшее помутнение раствора от выпавшей свободной серы.
Приготовить три раствора тиосульфата натрия различной концентрации. Для этого взять три пробирки, (рисунок 4.1) в первую внести 4 капли 1 н. раствора тиосульфата натрия и 8 капель воды; во вторую — 8 капель 1 н. раствора тиосульфата натрия и 4 капли воды; в третью — 12 капель 1 н. раствора тиосульфата натрия.
25
Рисунок 4.1 — Схема проведения опыта
Таким образом, в одинаковых объемах будет содержаться разное число моль Na2S2O3. В первую пробирку добавить 1 каплю 2 н. раствора серной кислоты и одновременно замерить время, прошедшее с момента добавления кислоты до появления в растворе заметной опалесценции. Также добавить по 1 капле 2 н. раствора серной кислоты по очереди во вторую и третью пробирки, замерив время до появления опалесценции. Данные опыта внести в таблицу.
№ |
ОбъемреагентовV; |
Общийобъем |
Концентрация |
Время |
Скорость |
|||
числокапель |
||||||||
пробир- |
раствора, Vобщ., |
раствора |
реакции |
реакцииυ; |
||||
Na2S2O3. |
|
H2SO4 |
Na2S2O3, С; |
|||||
ки |
H2O |
числокапель |
τ; с |
Моль/(лс) |
||||
|
1 н. |
|
2 н. |
|
моль/л. |
|
|
|
1 |
4 |
8 |
1 |
13 |
0,25 |
|
|
|
2 |
8 |
4 |
1 |
13 |
0,5 |
|
|
|
3 |
12 |
– |
1 |
13 |
1 |
|
|
|
Наблюдения и выводы
1.По полученным данным построить график зависимости скорости реакции от концентрации: на оси абсцисс откладывать концентрацию, на оси ординат — скорость реакции.
2.Определить скорость реакции в зависимости от концентрации.
Опыт 2. Влияние изменения концентраций исходных и конечных веществ на равновесие гомогенной химической реакции
Смещение равновесия обратимой реакции между хлоридом железа (III) и роданидом калия KSCN:
FeCl3 (ag) + 3 KSCN (ag) = Fe(SCN)3 (ag) + 3 KCl (ag). |
(4.5) |
Выполнение опыта
В четыре пробирки внести по 5–7 капель разбавленного 0,0025 н.
раствора хлорида железа (III) FeCl3 и такое же количество разбавленного раствора роданида калия KSCN. Одну пробирку с полу-
26
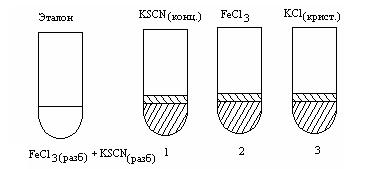
ченным раствором сохранить для сравнения результатов опыта (эталон).
В остальные пробирки добавить следующие реактивы: в первую — одну каплю концентрированного раствора роданида калия, во вторую — одну каплю концентрированного раствора хлорида железа (III), в третью — несколько кристалликов хлорида калия KCl (рисунок 4.2).
Сравнить интенсивность окраски полученных растворов с интенсивностью окраски эталона.
Рисунок 4.2 — Схема опыта
Составить уравнение соответствующей обратимой реакции.
Наблюдения и выводы
1.Какие вещества находятся в исследуемом растворе в момент равновесия?
2.Какое вещество придает раствору красную окраску?
3.Как изменяется интенсивность окраски раствора и в каком направлении смещается равновесие данной системы при добавлении:
–концентрированного раствора хлорида железа (III),
–концентрированного раствора роданида калия,
–кристаллов хлорида калия?
4.Проанализируйте смещение равновесия данной реакции, используя принцип Ле Шателье. Сделайте вывод: соответствуют ли теоретические выводы наблюдениям в опыте?
5.Запишите выражение константы равновесия предложенной реакции, укажите ее физический смысл.
27
Лабораторная работа № 5
ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ЗАМЕРЗАНИЯ АНТИФРИЗА
Цель работы:
1)определить температуру замерзания антифриза;
2)на практике убедиться, что растворы замерзают при температурах ниже, чем температура замерзания чистого растворителя.
Контрольные вопросы к лабораторной работе
1.Что такое антифриз и каким требованиям он должен удовлетворять?
2.Каков состав наиболее распространенного антифриза?
3.На чем основано действие антифризов?
4.Как формулируется и математически записывается криоскопический закон Рауля?
5. Почему раствор закипает при более высокой температуре, а замерзает при более низкой по сравнению с чистым растворителем?
Теоретическая часть
Обменные процессы в живых организмах, а также большинство процессов в промышленности и сельском хозяйстве протекают в водных растворах, что предопределяет необходимость знания характеристик и законов, лежащих в основе их описания.
Антифризы (жидкости, замерзающие при отрицательных температурах) применяются в системах охлаждения автомобильных, авиационных и тракторных двигателей при температуре окружающего воздуха от –75 до 0оС.
Они должны удовлетворять следующим требованиям: иметь высокую теплопроводность, низкую температуру замерзания, не вызывать коррозию металлических деталей в системе охлаждения, быть негорючими, неядовитыми и дешевыми.
Антифризы получают путем растворения в воде некоторых органических веществ (например, этиленгликоля, глицерина, этанола и др.) и антикоррозийных добавок: декстрина (1 г/л), гидроортофосфата (2,5–3,5 г/л Na2HPO4). Гидроортофосфат защищает от коррозии чугунные, стальные, медные и латунные детали; декстрин — свинцово-оловянные припои, алюминий и медь.
Маркировка антифризов связана с температурой их замерзания. Для зон с умеренным климатом рекомендуется антифриз А-65 и др.
28

Наиболее распространенным антифризом в настоящее время является водный раствор этиленгликоля НОН2С СН2ОН с соответствующими добавками. Этиленгликоль — бесцветная вязкая жидкость с температурой кипения +198оС (при 101,3 кПа), температурой замерзания –12оС.
Действие антифризов связано с криоскопическим законом Рауля, согласно которому понижение температуры замерзания (кристаллизации) раствора ∆tзам. по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества:
t = t0 |
−tзам.р. = KT Cm = KT |
m( X ) 1000 |
, |
(5.1) |
|
||||
|
|
M ( X ) ms |
|
|
где tо — температура замерзания чистого растворителя (воды); tзам. р. — температура замерзания раствора;
Cm — моляльная концентрация растворенного вещества, моль/кг; m(Х) — масса растворенного вещества, г;
M(X) — молярная масса растворенного вещества, г/моль; ms — масса растворителя (воды), г;
КT — криоскопическаяпостоянная(дляводыКT = 1,858 К·кг·моль–1).
Экспериментальная часть
Выполнение опыта
Рисунок 5.1 — Схема криоскопа
Для определения температуры замерзания применяют прибор, называемый криоскопом. Его схема приведена на рисунок 5.1
29
Прибор состоит из реакционной пробирки (1), куда помещается исследуемый раствор. Пробирка закрывается пробкой, в которую вставляются термометр (2) (с ценой деления 0,01–0,1ºС) и мешалку (3) — проволоку с кольцом на нижнем конце. Реакционная пробирка с термометром и мешалкой помещается в пробирку-термостат
(4) и вставляется в стакан (5) с охлаждающей смесью. В качестве охлаждающей смеси используется раствор хлорида натрия.
Для проведения эксперимента следует достать из прибора пробирку (1), вынуть пробку с термометром (2) и мешалкой (3) и налить в пробирку 10 см3 исследуемого раствора. Закрыть пробирку пробкой с термометром и мешалкой и тщательно перемешать раствор. Опустить пробирку с раствором в охладительную смесь и, непрерывно помешивая мешалкой раствор, наблюдать за изменением его температуры.
Наблюдения и выводы
1. Начиная примерно с +4оС, отмечать показания термометра через каждые 10 секунд. Полученные данные занести в таблицу.
Температурные данные
τ, с |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
t, оС |
|
|
|
|
|
|
|
|
|
|
2. Построить график зависимости изменения температуры раствора от времени – кривую охлаждения (рисунок 5.2 а, б).
Рисунок 5.2 — Кривая охлаждения
3.Определить по графику температуру замерзания раствора.
4.Используя криоскопический закон Рауля, рассчитать теоретическую температуру замерзания раствора антифриза. Растворенное вещество и его концентрацию называет преподаватель. Температуру замерзания чистой воды (растворителя) принять равной 0°С.
5.Найти абсолютнуюиотносительную погрешности эксперимента.
30
Лабораторная работа № 6
ХИМИЧЕСКИЕ РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Цель работы:
1)приобрести навык составления ионных уравнений в растворах электролитов;
2)закрепить знания по классификации и номенклатуре основных классов неорганических соединений.
Контрольные вопросы к контрольной работе
1.Какой процесс называется электролитической диссоциацией?
2.Как диссоциируют слабые многоосновные кислоты и многокислотные основания?
3.В каких случаях реакции в растворах электролитов протекают практически до конца?
4.Какие ионы участвуют в реакциях между растворами электролитов?
Теоретическая часть
Вещества, состоящие из ионных и сильно полярных молекул, при растворении в воде диссоциируют, образуя ионы. Свободные ионы обусловливают электропроводность раствора. Степенью диссоциации электролита α называется отношение числа диссоциированных молекул n к общему числу молекул растворенного вещества N:
α = |
n |
100% . |
(6.1) |
|
N |
||||
|
|
|
Если исходные вещества и продукты реакции — сильные электролиты (α > 30%), то между ними устанавливается ионное равновесие, не приводящее к образованию в преобладающем количестве какого-либо нового вещества.
Например:
в молекулярном виде
Na2SO4 + 2KNO3 = K2SO4 + 2NaNO3,
в ионном виде
2Na+ + SO42– + 2K+ + 2NO3– ↔ 2K+ + SO42– + 2Na+ + 2NO3–.
31
Равновесие реакции сдвигается вправо, если в результате реакции образуются:
1)слабые электролиты (3 % < α < 30 %),
а) NaOH + HCl = NaCl + H2O,
полное ионно-молекулярное уравнение:
Na+ + OH– + H+ + Cl– → Na+ + Cl– + H2O,
сокращенное ионно-молекулярное уравнение: OH– + H+ → H2O;
б) CH3COONa + HCl = CH3COOH + NaCl,
CH3COO– + Na+ + H+ + Cl– → CH3COOH + Na+ + Cl–,
CH3COO– + H+ → CH3COOH; в) NH4Cl + NaOH = NH3·Н2O + NaCl,
NH4+ + Cl– + Na+ + OH– → NH3·Н2O + Na+ + Cl–,
NH4+ + OH– → NH3·Н2O; г) KCN + AgCN = K[Ag(CN)2],
K+ + CN– + Ag+ + CN– → K+ + [Ag(CN)2]–,
CN– + Ag+ + CN– → [Ag(CN)2]– (комплексный ион).
2)малорастворимые вещества (осадки)
а) 2NaI + Pb(NO3)2 = PbI2↓ + 2NaNO3,
2Na+ + 2I– + Pb2+ + 2 NO3– → PbI2↓ + 2Na+ + 2NO3–,
2 I– + Pb2+ → PbI2↓; б) BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl,
Ba2+ + 2Cl– + 2Na+ + SO42– → BaSO4↓ + 2Na+ + 2Cl–,
Ba2+ + SO42– → BaSO4↓; 3) газообразное вещество
Na2S + 2HCl = H2S↑ + 2NaCl,
2Na+ +S2– + 2H+ + 2Cl– → H2S↑ + 2Na+ + 2Cl–,
S2– + 2H+ → H2S↑.
32
Экспериментальная часть
Опыт 1. Получение малорастворимых гидроксидов
Выполнение опыта
В одну пробирку налить 1 см3 0,5 н. раствора хлорида железа (III) или сульфата железа (III), в другую — 1 см3 0,5 н. сульфата меди (II), в третью — 1 см3 0,5 н. раствора хлорида аммония. В каждую пробирку по каплям прибавить 2 н. раствор гидроксида натрия или гидроксида калия до появления осадков.
Наблюдения и выводы
1.Отметить цвет образовавшихся осадков.
2.Написать молекулярные и ионно-молекулярные уравнения соответствующих реакций. Взаимодействие каких ионов происходит
вкаждом случае?
Опыт 2. Получение малорастворимых кислот
Выполнение опыта
В пробирку налить 1 см3 раствора силиката натрия (силикатный клей) с массовой долей 10%. Добавить несколько капель 1 н. раствора соляной кислоты до образования осадка.
Наблюдения и выводы
1.Какая малорастворимая кислота образовалась?
2.Написать молекулярное и ионно-молекулярные уравнения данного процесса. Какие катионы и анионы участвовали в образовании данной кислоты?
Опыт 3. Образование слабых кислот Выполнение опыта
Вдве пробирки налить 1 см3 0,5 н. раствора карбоната натрия.
Втретью пробирку внести 1 см3 0,5 н. раствора сульфида натрия.
Впервую пробирку добавить несколько капель 1 н. раствора соляной кислоты. Наблюдать появление пузырьков газа. Во вторую пробирку — столько же капель 1 н. раствора уксусной кислоты.
Втретью пробирку — по каплям 1 н. раствор соляной кислоты. Определите по запаху образование слабой кислоты сероводорода.
Наблюдения и выводы
1.Что образовалось в каждой из пробирок?
2.Написать молекулярные и ионно-молекулярные уравнения данных химических реакций. Какие ионы образовали полученные вещества?
33
Опыт 4. Получение малорастворимых солей
Выполнение опыта
В две пробирки налить по 1 см3 0,1 н. раствора нитрата свинца, в одну добавить несколько капель 2 н. раствора серной кислоты, во вторую — несколько капель 0,5 н. раствора иодида калия до образования осадков. В третью пробирку налить 1 см3 0,1 н. раствора хлорида железа (II) или сульфата железа (II), добавить несколько капель 0,5 н. раствора сульфида натрия до образования осадка.
Наблюдения и выводы
1.Отметить цвет образовавшихся осадков.
2.Написать молекулярные и ионно-молекулярные уравнения этих реакций.
3.Какие ионы участвовали в их образовании?
Опыт 5. Гидроксиды и их свойства Выполнение опыта
Вчетыре пробирки налить по 20 капель следующих 0,5 н. растворов: сульфата цинка, сульфата аммония, сульфата меди и сульфата марганца.
Вкаждую пробирку добавлять по каплям 2 н. раствор гидроксида натрия или гидроксида калия до образования осадков.
Каждый из полученных осадков взболтать и разделить на 2 части. На одну часть подействовать 1 н. раствором соляной кислоты, на другую — 2 н. раствором гидроксида натрия или калия (по каплям).
Наблюдения и выводы
1.Написать молекулярные и ионно-молекулярные уравнения реакций образования гидроксидов.
2.Процессы растворения гидроксидов в кислоте и в щелочи выразить молекулярными и ионно-молекулярными уравнениями реакций.
3.Сделать и записать выводы в форме таблицы.
Химические свойства полученных гидроксидов
Соль |
Полученный |
Растворимость гидроксида |
Характер гидроксида |
|
гидроксид |
|
|
(основной, кислотный, |
|
(формула) |
в кислоте |
в щелочи |
||
|
(формула) |
(да, нет) |
(да, нет) |
амфотерный) |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
34
Лабораторная работа № 7
ГИДРОЛИЗ СОЛЕЙ
Цель работы:
1)закрепить теоретические знания по химизму гидролиза;
2)приобрести навыки определения реакции среды рН экспрессметодом по универсальной индикаторной бумаге и с помощью рН-метра (потенциометра).
Контрольные вопросы к лабораторной работе
1.Что называют ионным произведением воды, чему оно равно и от чего зависит?
2.Какой показатель характеризует количественно реакцию среды? Что такое рН?
3.Что называют процессом гидролиза солей?
4.Какие соли подвергаются гидролизу?
5.В каких случаях наблюдается ступенчатый гидролиз? Как он протекает?
6.Каков характер среды при гидролизе по катиону?
7.Какая реакция среды создается в растворе при гидролизе по аниону?
8.Что определяет реакцию среды при гидролизе солей, образованных слабым гидроксидом и слабой кислотой?
9.Записать формулы констант гидролиза по катиону и аниону.
10.Что такое степень гидролиза и как она рассчитывается?
11.По какой формуле определяется изменение свободной энергии Гиббса реакции гидролиза?
12.Как практически можно определить реакцию среды в результате гидролиза соли?
Теоретическая часть
Гидролизом солей называют процесс обменного взаимодействия соли с водой, приводящего к образованию слабого электролита. При этом меняется реакция среды рН. В зависимости от силы кислоты и основания образуемые ими соли делят на четыре типа:
а) соль образована сильной кислотой и сильным основанием; б) соль образована сильной кислотой и слабым основанием; в) соль образована слабой кислотой и сильным основанием; г) соль образована слабой кислотой и слабым основанием.
35
Соли, образованные катионом сильного основания и анионом сильной кислоты, гидролизу не подвергаются. Равновесие диссоциации воды не нарушается, и среда таких солей остается нейтральной (рН = 7).
Гидролиз соли, образованной сильной кислотой и слабым основанием. Например, гидролизу подвергается сульфат меди (II) — соль образована сильной кислотой Н2SO4 и слабым основанием Cu(OH)2.
Диссоциация молекулы электролита на ионы протекает по уравнению
CuSO4 → Cu2+ + SO42–.
Уравнение гидролиза по катиону запишется в виде:
а) сокращенного ионно-молекулярного (по I ступени, если основание двух- и более кислотное)
Cu2+ + HOH ↔ CuOH+ + H+, |
рН < 7 |
б) полного ионно-молекулярного уравнения |
|
Cu2+ + SO42– + HOH ↔ CuOH+ + H+ + SO42–,
в) полного молекулярного уравнения
2CuSO4 + 2H2O ↔ (CuOH)2SO4 + H2SO4.
Гидролиз по катиону приводит к связыванию гидроксид-ионов воды и накоплению ионов водорода, образуя кислую среду (рН < 7). Константа гидролиза Кг равна:
K Г = |
KW |
, |
(7.1) |
|
KII (Cu(OH2 )) |
||||
|
|
|
где КW – ионное произведение воды, равное 10–14 (моль/л)2;
КII (Cu(OH)2) – константа диссоциации слабого гидроксида по последней (второй) ступени.
рН раствора можно рассчитать по формуле:
рНг = –½ lg Kг – ½ lg C, |
(7.2) |
где С – молярная концентрация соли, моль/л.
Гидролиз соли, образованной слабой кислотой и сильным основанием. Например, сульфит калия — соль образована сильным основанием КOH и слабой двухосновной кислотой H2SO3. Диссоциация молекулы электролита на ионы протекает по уравнению
36

К2SO3 → 2К+ + SO32–.
Уравнение гидролиза по аниону запишется в виде: а) сокращенного ионно-молекулярного
SO32– + HOH ↔ HSO3– + OH–, |
pH > 7 |
б) полного ионно-молекулярного уравнения |
|
2К+ + SO32– + HOH ↔ HSO3– + OH– + 2К+ ,
в) полного молекулярного уравнения
К2SO3 + НОН ↔ КHSO3 + КOH.
Гидролиз по аниону приводит к связыванию ионов водорода воды и накоплению гидроксид-ионов, создавая щелочную среду (рН > 7). Константа гидролиза равна:
K Г = |
KW |
, |
(7.3) |
|
KII (H2SO3 )) |
||||
|
|
|
где КII (Н2SO3) – константа диссоциации слабой кислоты по последней ступени. рОН раствора можно рассчитать по формуле
рОН = –½ lg Кг – ½ lg C, |
(7.4) |
рН = 14 – рОН. |
(7.5) |
Гидролиз соли, образованной слабой кислотой и слабым основанием. Например, карбонат аммония – соль образована слабым основанием NН3 НOH (NH4OH) и слабой двухосновной кислотой H2CO3. Диссоциация молекулы электролита на ионы протекает по уравнению
(NH4)2CO3 → 2NH4+ + CO32– .
Уравнение гидролиза по аниону и по катиону запишется в виде (по первой ступени):
а) полного ионно-молекулярного уравнения
NH4+ + CO32– + H2O → NH4OH + HCO3– ;
б) полного молекулярного уравнения
(NH4)2CO3 + H2O → NH4OH + NH4HCO3.
рН среды определяется относительной силой кислоты и гидроксида.
37
Если Ккисл. ≈ Кгидр. — среда нейтральная; Ккис. > Кгидр. — среда слабокислая; Ккисл. < Кгидр. — среда слабощелочная.
В реакцию с водой вступают катионы слабых гидроксидов и анионы слабых кислот. Если эти ионы многозарядны (Fe3+, Cu2+, CO32–, SiO32– и др.), то в результате гидролиза образуется гидроксокатион (МеОН)+ или гидроанион (НR)– (первая ступень гидролиза). Гидролиз солей, как равновесный процесс, характеризуется константой гидролиза Кг и степенью гидролиза h. Степень гидролиза есть отношение числа гидролизованных молекул к общему числу растворенных молекул соли. Степень гидролиза рассчитывается из соотношения:
h = |
K Г |
|
C . |
(7.6) |
Глубина протекания процесса определяется природой соли. Степень гидролиза зависит от природы соли, температуры и концентрации раствора.
Знание процессов, протекающих при гидролизе солей, необходимо инженеру сельскохозяйственного профиля в его практической деятельности. Например, при внесении минеральных удобрений в почву может измениться и ее кислотность, которая оказывает большое влияние на развитие растений и почвенных микроорганизмов, на скорость и направленность химических и биохимических процессов в ней.
Установлена связь между урожаем и концентрацией ионов водорода в почве. Картофель дает хороший урожай при pH = 5,0÷5,5, для овса оптимально pH = 5,3÷5,8, а при pH = 4,3 он гибнет. Из кислых почв растения легко поглощают радиоактивный Cs-137 и другие радионуклиды. Реакция среды имеет важное значение в электролитических процессах, при коррозии металлов и др.
Экспериментальная часть
Опыт 1. Определение реакции среды в результате гидролиза солей: а) хлорида алюминия; б) карбоната натрия.
Выполнение опыта
Каплю испытуемого 0,5 н. раствора нанести на универсальную индикаторную бумагу. Полученную окраску сравнить со шкалой цветов и установить величину pH.
38
Наблюдения и выводы
1. Результаты исследований занести в таблицу.
|
|
Цвет |
|
Концентрация, |
|
Испытуемый |
Концентрация |
универсальной |
Величина pH |
моль/л |
|
|
|
||||
раствор соли |
|
индикаторной |
|
CH+ |
COH- |
|
|
бумаги |
|
||
AlCl3 |
0,5 н. |
|
|
|
|
Na2CO3 |
0,5 н. |
|
|
|
|
2. Написать молекулярные и ионно-молекулярные (полное и сокращенное) уравнения реакций гидролиза данных солей по первой ступени.
3. Назвать полученные при гидролизе (по I ступени) вещества.
Опыт 2. Совместный гидролиз двух солей
Выполнение опыта
В пробирку внести 6–8 капель 0,5 н. раствора карбоната натрия, добавить столько же 0,5 н. раствора хлорида алюминия.
Наблюдения и выводы
1.Отметить выделение пузырьков газа и выпадение осадка.
2.Написать молекулярное и ионные уравнения совместного гидролиза.
3.Что происходит при растворении в воде солей, образованных слабым основанием и слабой кислотой?
4.Почему в таблице растворимостей напротив таких солей (CuS) стоит прочерк?
5.Определить реакцию среды, используя константы диссоциации, образовавшихся слабых электролитов:
KII (H2CO3) = 4,7 10–11; KIII (Al(OH)3) = 1,4 10–9.
Опыт 3. Определение реакции среды pH с помощью pH-метра в растворах солей: NH4NO3, Na3PO4, KCl, являющихся удобрениями
Выполнение опыта
В стакан емкостью 50 см3 налить 40 см3 0,1 н. раствора нитрата аммония NH4NO3. Перед определением pH электроды промыть 2–3 раза дистиллированной водой.
Определить по шкале ориентировочное значение рН раствора, а затем перейти на более чувствительный диапазон измерений.
39
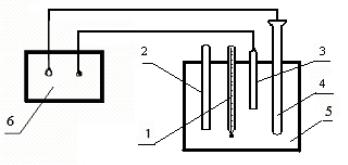
Рассмотреть рисунок 7.1 установки для потенциометрического измерения рН растворов.
Рисунок 7.1 — Схема установки для потенциометрического определения рН растворов:
1 – термометр; 2 – палочка для перемешивания раствора; 3 – стеклянный электрод; 4 – хлорсеребряный электрод; 5 – стакан с раствором соли; 6 – pH-метр
Определить таким же способом pH 0,1 н. растворов фосфата натрия Na3PO4 и хлорида калия KCl.
Наблюдения и выводы
1.Записать результаты значений pH для исследуемых растворов (оформить в виде таблицы) и сделать вывод о характере реакции среды в растворах данных солей..
2.Написать молекулярные и ионно-молекулярные реакции гидролиза данных солей по I ступени. Назвать полученные при гидролизе вещества.
3.Рассчитать абсолютную и относительную ошибки, используя рассчитанные и экспериментально измеренные значения рН.
4.Какую из данных солей можно вносить для нейтрализации кислой почвы?
40
