
- •II. Основы молекулярной физики и термодинамики
- •1. Молекулярно-кинетическая теория идеальных газов
- •1.1 Уравнение состояния
- •1.2 Уравнение состояния Ван-дер-Ваальса
- •1.3 Внутренняя энергия
- •1.4 Статистические распределения
- •1.4.1 Распределение Максвелла
- •1.4.2 Распределение Больцмана
- •1.5 Среднее число столкновений и средняя длина свободного пробега молекул
- •1.6 Явления переноса в газах
1.4.1 Распределение Максвелла
В
состоянии теплового равновесия как бы
не изменялись скорости молекул при
столкновениях, средняя квадратичная
скорость молекул в газе, при Т=cоnst,
остается постоянной и равной
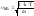 .
.
Это объясняется тем, что в газе устанавливается некоторое стационарное статистическое распределение молекул по значениям скоростей, называемое распределением Максвелла. Распределение Максвелла описывается некоторой функцией f(), называемой функцией распределения молекул по скоростям.
 ,где
N
– общее число молекул, dN()
– число молекул, скорости которых
принадлежат интервалу скоростей от
до
+ d.
,где
N
– общее число молекул, dN()
– число молекул, скорости которых
принадлежат интервалу скоростей от
до
+ d.
Таким образом, функция Максвелла f() равна вероятности того, что величина скорости наугад выбранной молекулы принадлежит единичному интервалу скоростей вблизи значения . Или она равна доле молекул, скорости которых принадлежат единичному интервалу скоростей вблизи значения .
Явный вид функции f() был получен теоретически Максвеллом:
 .
.
График функции распределения приведен на рис. 12. Из графика следует, что функция распределения стремится к нулю при 0 и и проходит через максимум при некоторой скорости В, называемой наиболее вероятной скоростью. Этой скоростью и близкой к ней обладает наибольшее число молекул. Кривая несимметрична относительно В. Значение наиболее вероятной скорости можно найти, используя условие для максимума функции f().
 .
.
На рис. 13 показано смещение В с изменением температуры, при этом площадь под графиком остается постоянной и равной 1, что следует из условия нормировки функции Максвелла
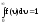 .
.
Условие нормировки следует из смысла данного интеграла – он определяет вероятность того, что скорость молекулы попадает в интервал скоростей от 0 до . Это достоверное событие, его вероятность, по определению, принимается равной 1.
Знание функции распределения молекул газа по скоростям позволяет вычислять средние значения любых функций скорости, в частности средней арифметической скорости <>.
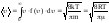 .
.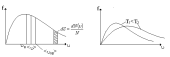
Рис.12 Рис. 13
По функции Максвелла можно определить долю молекул, скорости которых принадлежат заданному интервалу скоростей или превышают некоторое значение скорости, например вторую космическую, что определяет рассеяние атмосферы.
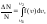
 .
.
1.4.2 Распределение Больцмана
Тепловое движение частиц тела приводит к тому, что положение их в пространстве изменяется случайным образом. Поэтому можно ввести функцию распределения частиц по координатам, определяющую вероятность обнаружения частицы в том или ином месте пространства.
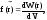 где
где
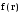
плотность вероятности, т.е. вероятность
обнаружения частицы в единичном объеме
вблизи точки с радиус-вектором
плотность вероятности, т.е. вероятность
обнаружения частицы в единичном объеме
вблизи точки с радиус-вектором
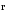 .
.
При отсутствии внешних силовых полей существует равномерное распределение частиц идеального газа по координатам, при этом можно записать
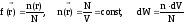 ,
,
где n концентрация частиц, N полное число частиц газа.
Внешнее
силовое поле изменяет пространственное
распределение частиц, при этом
концентрация частиц и функция
распределения зависят от координат.
Если внешнее силовое поле является
потенциальным, то концентрация частиц
вблизи точки пространства с
радиусом-вектором
 зависит от потенциальной энергии частиц
в данном месте:
зависит от потенциальной энергии частиц
в данном месте:
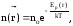 где
no
концентрация частиц в том месте, где
Ep=0.
где
no
концентрация частиц в том месте, где
Ep=0.
В
этом случае вероятность обнаружить
частицу в объеме dV
вблизи точки с радиусом-вектором
 определяется выражением
определяется выражением
 .
.
Этот закон называется распределением Больцмана.
Для идеального газа давление связано с концентрацией соотношением Р=nkT. В поле земного тяготения концентрация изменяется с высотой над поверхностью Земли, и если газ находится в равновесном состоянии при температуре Т, то изменение давления с высотой происходит по закону
 .
.
Последнее соотношение называется барометрической формулой. В действительности земная атмосфера не находится в равновесном состоянии, ее температура меняется с высотой, и барометрическую формулу следует применять к участкам атмосферы, в пределах которых изменением температуры можно пренебречь. Из барометрической формулы следует, что давление различных газов изменяется с высотой по-разному. На рис. 14 показано изменение давления газа с высотой для различных газов при T = const, а на рис. 15 – изменение давления газа ( = const) при разных температурах.
