
Тест по теме «Фосфор и его соединения»
1. Исключите
«лишний» элемент из перечисленных по
принципу возможности образования
аллотропных модификаций:
а) кислород; б) азот;
в) фосфор; г) сера.
2. При взаимодействии 42,6 г фосфорного ангидрида и 400 г 15%-го раствора гидроксида натрия образуется:
а) фосфат натрия;
б) гидрофосфат натрия;
в) смесь фосфата и гидрофосфата натрия;
г) смесь гидро- и дигидрофосфата натрия.
3. Сумма коэффициентов в уравнении электролитической диссоциации фосфата калия равна:
а) 5; б) 3; в) 4; г) 8.
4. Число электронов на внешнем уровне атома фосфора:
а) 2; б) 3; в) 5; г) 15.
5. Фосфор, полученный из 33 г технического фосфата кальция, сожгли в кислороде. Образовавшийся оксид фосфора(V) прореагировал с 200 мл 10%-го раствора гидроксида натрия (плотность – 1,2 г/мл) с образованием средней соли. Масса примесей в техническом образце фосфата кальция (в г) составляет:
а) 3,5; б) 1,5; в) 2; г) 4,8.
6. Число ![]() -связей
в молекуле пирофосфорной кислоты:
-связей
в молекуле пирофосфорной кислоты:
а) 2; б) 12; в) 14; г) 10.
7. Число атомов водорода, содержащихся в 4,48 л (н.у.) фосфина равно:
а) 1,2•1023; б) 0,6•1023;
в) 6,02•1023; г) 3,6•1023.
8. При температуре 30 °С некая реакция протекает за 15 с, а при 0 °С – за 2 мин. Коэффициент Вант-Гоффа для данной реакции:
а) 2,4; б) 2; в) 1,8; г) 3.
9. Ортофосфорная кислота может реагировать со следующими веществами:
а) оксид меди(II); б)гидроксид калия;
в) азотная кислота; г) цинк.
10. Сумма коэффициентов в реакции между фосфором и бертолетовой солью равна:
а) 9; б) 6; в) 19; г) такая реакция невозможна.
Ключ к тесту
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
б |
в |
а |
в |
в |
б |
г |
б |
а, б ,г |
в |
Задачи и упражнения на фосфор и его соединения
Ц
е п о ч к и п р е в р а щ е н и й:
1. Фосфор —> пентаоксид фосфора —> ортофосфорная кислота —> фосфат кальция ® фосфорная кислота.
2. Фосфат кальция —> фосфор —> фосфид кальция —> фосфин —> пентаоксид фосфора —> фосфорная кислота —> дигидрофосфат кальция.
3. Фосфат кальция —> А —> В —> С —> Д —> Е —> фосфат кальция. Все вещества содержат фосфор, в схеме три ОВР подряд.
4. Фосфор —> пентаоксид фосфора —> фосфат кальция —> фосфор —> фосфин —> фосфорная кислота —> дигидрофосфат кальция.
5. Фосфид
кальция (+ р-р соляной кислоты) —> А (+
кислород) —> В (+ гидроксид натрия,
недостаток) —> С (+ гидроксид натрия,
избыток) —> Д (+ гидроксид кальция) —>
Е![]() .
.
|
У р о в е н ь А |
1. При полном сгорании 6,8 г вещества получили 14,2 г пентаоксида фосфора и 5,4 г воды. К полученным продуктам реакции добавили 37 мл 32%-го раствора едкого натра (плотность 1,35 г/мл). Установите формулу исходного вещества и определите концентрацию полученного раствора.
Решение
Уравнение реакции:
![]()
![]() (P2O5)
= 0,1 моль,
(P2O5)
= 0,1 моль, ![]() (H2O)
= 0,3 моль.
(H2O)
= 0,3 моль.
![]() (P)
= 0,2 моль,
(P)
= 0,2 моль, ![]() (H)
= 0,6 моль.
(H)
= 0,6 моль.
m(P) = 6,2 г, m(H) = 0,6 г.
![]() m =
6,8 г.
m =
6,8 г.
![]() (P)
:
(P)
: ![]() (Н)
= 0,2 : 0,6 = 1 : 3.
(Н)
= 0,2 : 0,6 = 1 : 3.
Следовательно, формула исходного вещества – PH3, а уравнение реакции:

тогда фосфорной кислоты образуется:
![]() (H3PO4)
= 2
(H3PO4)
= 2![]() (P2O5)
= 0,2 моль.
(P2O5)
= 0,2 моль.
Со щелочью фосфорная кислота может реагировать следующим образом:
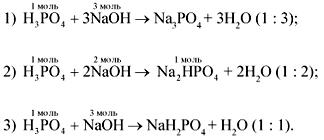
Определим по условию задачи количество вещества NaOH:

![]() (Н3PO4)
:
(Н3PO4)
: ![]() (NaOН)
= 0,2 : 0,4 = 1 : 2,
(NaOН)
= 0,2 : 0,4 = 1 : 2,
следовательно, идет реакция 2.
![]() (Na2HPO4)
=
(Na2HPO4)
= ![]() (Н3PO4)
= 0,2 моль;
(Н3PO4)
= 0,2 моль;
m(Na2HPO4)
= M(Na2HPO4)•![]() (Na2HPO4)
= 142•0,2 = 28,4 г;
(Na2HPO4)
= 142•0,2 = 28,4 г;
m(р-ра) = m(Р2О5) + m(Н2О) + m(р-ра NaOH) =14,2 + 5,4 + 37•1,35 = 69,55 г.
![]() (Na2HPO4)
= m(Na2HPO4)/m(р-ра)
= 28,4/69,55 = 0,4083, или 40,83 %.
(Na2HPO4)
= m(Na2HPO4)/m(р-ра)
= 28,4/69,55 = 0,4083, или 40,83 %.
Ответ. PH3; ![]() (Na2HPO4)
= 40,83 %.
(Na2HPO4)
= 40,83 %.
2. При полном электролизе 1 кг раствора сульфата железа(II) на катоде выделилось 56 г металла. Какая масса фосфора может вступить в реакцию с веществом, выделившимся на аноде, и каков будет состав соли, если полученный продукт реакции растворить в 87,24 мл 28%-го раствора гидроксида натрия (плотность раствора 1,31 г/мл)?
Ответ. 12,4 г фосфора; гидрофосфат натрия.
3. 20 г смеси, состоящей из сульфата бария, фосфата кальция, карбоната кальция и фосфата натрия, растворили в воде. Масса нерастворившейся части составила 18 г. При действии на нее соляной кислоты выделилось 2,24 л газа (н.у.) и масса нерастворимого остатка составила 3 г. Определите состав исходной смеси солей по массе.
Ответ. Na3PO4 – 2 г; BaCO3 – 3 г; CaCO3 – 10 г; Ca3(PO4)3 – 5 г.
4. Сколько кг фосфора может быть получено из 1 т фосфорита, содержащего 40 % примесей? Какой объем при н.у. займет фосфин, полученный из этого фосфора?
Ответ. 120 кг P; 86,7 м3 PH3.
5. 40 г минерала, содержащего 77,5 % фосфата кальция, смешали с избытком песка и угля и нагрели без доступа воздуха в электрической печи. Полученное простое вещество растворили в 140 г 90%-й азотной кислоты. Определите массу гидроксида натрия, который потребуется для полной нейтрализации продукта окисления простого вещества.
Ответ. 24 г NaOH.
|
У р о в е н ь Б |
1. Для полной нейтрализации раствора, полученного при гидролизе 1,23 г некоторого галогенида фосфора, потребовалось 35 мл 2М раствора гидроксида калия. Определите формулу галогенида.
Ответ. Трифторид фосфора.
2. Пробу безводного этанола, содержащего в качестве примеси 0,5 % оксида фосфора(V), сожгли в достаточном количестве кислорода. Образовавшиеся газы отделили, а полученный раствор нагрели до прекращения выделения газа, после чего к нему добавили равный по массе 0,5%-й раствор гидроксида калия. Определите массовые доли веществ в полученном растворе.
Ответ. K2HPO4 – 0,261 %; KH2PO4 – 0,204 %.
3. К 2 г смеси гидрофосфата и дигидрофосфата калия, в которой массовая доля фосфора равна 20 %, добавили 20 г 2%-го раствора фосфорной кислоты. Вычислите массовые доли веществ в полученном растворе.
Ответ. KH2PO4 – 9,03 %; K2HPO4 (ост.) – 1,87 %.
4. При обработке водой смеси гидрида и фосфида щелочного металла с равными массовыми долями образовалась газовая смесь с плотностью по азоту 0,2926. Установите, какой металл входил в состав соединений.
Ответ. Натрий.
5. 50 г смеси фосфата кальция и карбонатов кальция и аммония прокалили, в результате получили 25,2 г твердого остатка, к которому добавили воду, а затем пропустили избыток углекислого газа. Масса нерастворившегося остатка составила 14 г. Определите массу карбоната аммония в исходной смеси.
Решение
При прокаливании смеси идут следующие процессы:
1)
Ca3(PO4)2 ![]() ;
;
2) ![]()
3)
(NH4)2CO3 ![]() 2NH3
2NH3![]() +
СO2
+
СO2![]() +
H2O
+
H2O![]() .
.
В твердом остатке – Са3(PO4)2 и CaO.
После добавления воды:
4)
Ca3(PO4)2 +
H2O![]() ;
;
5) СаО + H2O = Ca(OH)2.
После пропускания углекислого газа:
6) Са(ОН)2 + H2O + CO2 = Ca(HСО3)2.
Нерастворившийся остаток – Ca3(PO4)2, следовательно, m(Ca3(PO4)2) = 14 г.
Находим массу CaO:
m(CaO) = 25,2 – 14 = 11,2 г.
![]() (CaO)
= 11,2/56 = 0,2 моль,
(CaO)
= 11,2/56 = 0,2 моль,
![]() (CaCO3)
=
(CaCO3)
= ![]() (CaO)
= 0,2 моль,
(CaO)
= 0,2 моль,
тогда
m(CaCO3) = 0,2•100 = 20 г.
m(NH4)2CO3 = m(смеси) – m(Ca3(PO4)2) – m(CaCO3) = 50 – 14 – 20 = 16 г.
Ответ. m(NH4)2CO3 = 16 г.
К а ч е с т в е н н ы е з а д а ч и
1. Твердое, белое, хорошо растворимое в воде соединение А представляет собой кислоту. При добавлении к водному раствору А оксида В образуется белое нерастворимое в воде соединение С. В результате прокаливания при высокой температуре вещества С в присутствии песка и угля образуется простое вещество, входящее в состав А. Идентифицируйте вещества, напишите уравнения реакций.
Ответ. Вещества: А – H2PO4, В – CaO, C – Ca3(PO4)2.
2. Смесь двух твердых веществ красного цвета (А) и белого цвета (В) воспламеняется при слабом трении. В результате реакции образуются два твердых вещества белого цвета, одно из которых (С) растворяется в воде с образованием кислого раствора. Если к веществу С добавить оксид кальция, образуется белое нерастворимое в воде соединение. Идентифицируйте вещества, напишите уравнения реакций.
Ответ. Вещества: А – P (кр.), В – KClO3, C – P2O5.
3. Нерастворимое в воде соединение А белого цвета в результате прокаливания при высокой температуре с углем и песком в отсутствии кислорода образует простое вещество В, существующее в нескольких аллотропных модификациях. При сгорании вещества В образуется соединение С, растворяющееся в воде с образованием кислоты Е, способной образовывать три типа солей. Идентифицируйте вещества, напишите уравнения реакций.
Ответ. Вещества: А – Ca3(PO4)2, В – P, C – P2O5, Е – H3PO4.
