
Пособие-репетитор по химии занятие 33
10-й класс (первый год обучения)
Углерод и его соединения
П л а н
1.
Положение в таблице Д.И.Менделеева,
строение атома.
2. Краткая история открытия и происхождение названия.
3. Физические свойства. Аллотропные модификации углерода.
4. Химические свойства.
5. Нахождение в природе.
6. Основные методы получения.
7. Важнейшие соединения углерода (угарный газ, углекислый газ, угольная кислота и ее соли).
Углерод
находится в главной подгруппе IV группы
периодической системы химических
элементов. Электронная формула атома
углерода имеет вид 1s22s2p2,
это р-элемент,
проявляющий неметаллические свойства.
В невозбужденном состоянии углерод
проявляет валентность II, при переходе
в возбужденное состояние – IV.
Характерные степени окисления в
соединениях –4, +2, +4, например: ![]() .
.
С: 1s22s22p2 (валентность II),
![]()
С*: 1s22s12p3 (валентность IV).
![]()
Характерной особенностью углерода является его способность к образованию углерод-углеродных цепей, что обуславливает существование органических молекул. Для органических соединений понятие степени окисления является очень условным, например:
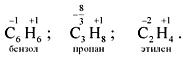
Русское название углерода означает “рождающий уголь”. Латинское название carboneum также означает “уголь”.
Ф и з и ч е с к и е с в о й с т в а
Химический элемент углерод в виде простого вещества образует несколько аллотропных модификаций.
Алмаз – аллотропная модификация углерода, существующая в природе и полученная искусственным путем. По внешнему виду это прозрачные кристаллы высокой твердости. После обработки природных алмазов получают драгоценный камень – бриллиант. Кристаллическая решетка алмаза имеет тетраэдрическое строение, расстояние между всеми атомами углерода одинаковое, что обусловлено ихsp3-гибридизацией. В кристаллической решетке алмаза отсутствуют свободные электроны, поэтому алмаз не проводит электрического тока. Химическая активность алмаза ниже активности другой аллотропной модификации углерода – графита.
Графит – мягкое темно-серое вещество с металлическим блеском, жирное на ощупь. Графит легко измельчается (порошок графита называется сажей). Кристаллическая решетка графита имеет слоистое строение и состоит из слоев правильных шестиугольников, конденсированных по всем сторонам. Атомы углерода в графите находятся в состоянии sp2-гибридизации. В образовании химических связей участвуют три электрона атома углерода, а четвертый электрон остается относительно свободным, что обеспечивает высокую электропроводность графита.
Карбин – аллотропная модификация углерода, очень редко встречающаяся в природе. Это полимер, состоящий из линейных макромолекул, атомы углерода находятся в состоянии sp-гибридизации. Карбин – прозрачное и бесцветное вещество, полупроводник. В химическом отношении менее активен, чем графит. Широкого применения не имеет.
Фуллерен – порошок темного цвета (после очистки перекристаллизацией – желтые кристаллы), полупроводник. В природе эта аллотропная модификация углерода не встречается, получена искусственным путем, в настоящее время изучаются свойства фуллерена. Состоит из молекул состава С60 или С70, атомы углерода находятся в состоянии sp2-гибридизации. Объемная молекула фуллерена имеет полициклическое строение, по внешнему виду напоминает футбольный мяч.
Х и м и ч е с к и е с в о й с т в а
В химическом отношении углерод при обычных условиях малоактивен, но при нагревании реагирует со многими простыми и сложными веществами. В реакциях углерод может быть как восстановителем, так и окислителем.
Н2 (+/–)*:
C
+ 2H2
![]() CH4.
CH4.
О2 (+):
C
+ O2 ![]() CO2,
CO2,
2C
+ O2 ![]() 2CO.
2CO.
Металлы (+/–):
4Al
+ 3C ![]() Al4C3,
Al4C3,
2C
+ Ca ![]() CaC2,
CaC2,
Ag,
Au, Pt + ![]() реакция
не идет.
реакция
не идет.
Неметаллы (+/–):
С
+ 2S ![]() CS2,
CS2,
C
+ 2F2 ![]() CF4.
CF4.
Н2О (+):
С
+ Н2О
(г. ) ![]() CO
+ H2.
CO
+ H2.
Основные оксиды (+):
2PbO
+ C ![]() 2Pb
+ CO2,
2Pb
+ CO2,
CaO
+ C ![]() Ca
+ CO,
Ca
+ CO,
или
CaO
+ 3C (кокс) ![]() CaC2 +
CO.
CaC2 +
CO.
Кислотные оксиды (–).
Основания (–).
Кислоты-неокислители (–).
Кислоты-окислители (+):
С
+ 2H2SO4 (конц.)
=
CO2![]() +
2SO2
+
2SO2![]() +
2H2O,
+
2H2O,
С
+ 4HNO3 (конц.)
= CO2![]() +
4NO2
+
4NO2![]() +
2H2O,
+
2H2O,
3С
+ 4HNO3 (разб.)
=
3CO2![]() +
4NO
+
4NO![]() +
2H2O.
+
2H2O.
Соли (+):
![]()
В природе углерод встречается как в виде простого вещества (см. аллотропные модификации), так и в виде соединений, важнейшими из которых являются: мел, мрамор, известняк (CaCO3), доломит (CaCO3•MgCO3) и др. В атмосфере углерод содержится в виде угарного и углекислого газов. Соединения углерода – основные компоненты природного топлива. Кроме того, все органические соединения являются соединениями углерода.
В а ж н е й ш и е с о е д и н е н и я у г л е р о д а
Оксид углерода(II), или угарный газ (СО). Газ без цвета, вкуса и запаха, легче воздуха, плохо растворим в воде, токсичен. Термически устойчив. Атомы в молекуле угарного газа связаны двумя видами ковалентной связи: ковалентной полярной и донорно-акцепторной (кислород является донором, углерод – акцептором):
![]()
По химическим свойствам угарный газ является несолеобразующим оксидом, химически достаточно пассивен. При повышенной температуре оксид углерода(II) взаимодействует с кислородом и оксидами металлов, являясь сильным восстановителем, например:
2CO
+ O2 ![]() 2CO2,
2CO2,
CO
+ MgO ![]() Mg
+ CO2.
Mg
+ CO2.
При пропускании смеси угарного газа и хлора через слой активированного угля можно получить ядовитый газ фосген (химическое оружие, вызывает паралич дыхательных путей):
CO
+ Cl2 ![]() COCl2.
COCl2.
При нагревании монооксида углерода с водородом в присутствии катализатора при повышенном давлении образуется метиловый спирт:
CO
+ 2H2 ![]() CH3OH.
CH3OH.
При пропускании угарного газа через расплав щелочи при высоком давлении образуется соль муравьиной кислоты, поэтому формально монооксид углерода можно рассматривать как ангидрид муравьиной кислоты:
CO
+ KOH (расплав) ![]() HCOOK.
HCOOK.
Лабораторный метод получения угарного газа – разложение муравьиной кислоты при нагревании в присутствии дегидратирующего агента:
HCOOH
![]() CO
+ H2O.
CO
+ H2O.
Кроме того, угарный газ можно получить неполным сжиганием кокса или восстановлением углекислого газа раскаленным коксом (t > 1000 °С):
2C
+ O2 ![]() 2CO,
2CO,
CO2 +
С ![]() 2CO.
2CO.
Оксид углерода(IV), или углекислый газ (СО2). Газ без цвета, вкуса и запаха, тяжелее воздуха, растворим в воде (88 объемов углекислого газа в 100 объемах воды), не поддерживает горения и дыхания (правда, в атмосфере углекислого газа могут гореть некоторые активные металлы, отнимая кислород, например магний):
CO2 +
2Mg ![]() 2MgO
+ C.
2MgO
+ C.
В
молекуле CO2 атом
углерода образует две ![]() -связи
c атомами кислорода. В образовании
-связи
c атомами кислорода. В образовании ![]() -связей
принимают участие две гибридные sp-орбитали.
Поэтому молекула углекислого газа имеет
линейное строение, неполярна:
-связей
принимают участие две гибридные sp-орбитали.
Поэтому молекула углекислого газа имеет
линейное строение, неполярна:
![]()
В химическом отношении диоксид углерода проявляет все свойства кислотного оксида:
CO2 +
H2O ![]() H2CO3,
H2CO3,
CO2 +
CaO ![]() CaCO3,
CaCO3,
CO2 + 2NaOH = Na2CO3 + H2O
или
CO2 + NaOH = NaHCO3.
Качественная реакция на углекислый газ – пропускание его через известковую или баритовую воду:
Ca(OH)2 +
CO2 =
CaCO3![]() +
H2O,
+
H2O,
![]()
аналогично протекает реакция с Ba(OH)2.
Углекислый газ можно получить разложением известняка:
CaCO3 ![]() CaO
+ CO2
CaO
+ CO2![]() ,
,
действием на карбонаты металлов растворами сильных минеральных кислот:
CaCO3 +
2HCl = CaCl2 +
H2O
+ CO2![]() ,
,
при полном сжигании кокса:
C
+ O2 ![]() CO2.
CO2.
Угольная кислота (H2CO3) и ее соли. Угольная кислота – слабая двухосновная кислота, в свободном виде не получена, существует только в растворе. Молекула имеет полярное строение, атомы углерода вsp2-гибридизации. Термически неустойчива, проявляет все свойства, характерные для слабых кислот (даже органические кислоты вытесняют угольную из ее солей):
H2CO3 ![]() H2O
+ CO2,
H2O
+ CO2,
H2CO3 +
Zn = ZnCO3 +
H2![]() ,
,
H2CO3 + CaO = CaCO3 + H2O.
Угольная кислота, как двухосновная, образует два типа солей: карбонаты и гидрокарбонаты:

Все карбонаты, кроме карбонатов щелочных металлов, разлагаются при нагревании, например:
MgCO3 ![]() MgO
+ CO2,
MgO
+ CO2,
но
Na2CO3 ![]() .
.
Качественной реакцией на карбонаты и гидрокарбонаты является их взаимодействие с растворами сильных минеральных кислот, например:
Na2CO3 +
2HCl = NaCl + H2O
+ CO2![]() ,
,
NaHCO3 +
HCl = NaCl + H2O
+ CO2![]() .
.
