
- •Дніпропетровський університет імені альфреда нобеля
- •Загальні положення
- •2. Правила з техніки безпеки під час роботи у лабораторії
- •Слід дотримуватися таких правил безпеки:
- •Під час роботи в лабораторії категорично забороняється:
- •Перша допомога у разі нещасних випадків
- •4. Завдання до лабораторних робіт лабораторна робота 1
- •Зміст роботи:
- •Хід роботи:
- •3. Написати звіт про виконану роботу. Лабораторна робота 2
- •Зміст роботи:
- •Хід роботи:
- •Лабораторна робота 3
- •Зміст роботи:
- •Хід роботи:
- •Лабораторна робота 4
- •Зміст роботи:
- •Хід роботи:
- •Лабораторна робота 5
- •Зміст роботи:
- •Хід роботи:
- •Лабораторна робота 6
- •Зміст роботи:
- •Хід роботи:
- •Хід роботи:
- •Орієнтовний перелік питань для підсумкового контролю
- •Лабораторна робота 7
- •Зміст роботи:
- •Хід роботи:
- •Хід роботи:
- •Хід роботи:
- •Орієнтовний перелік питань для підсумкового контролю
- •Лабораторна робота 8
- •Зміст роботи:
- •Хід роботи: Органолептична оцінка якості м’яса
- •Визначення продуктів первинного розкладу білків у бульйоні
- •Хід роботи:
- •Таблиця 5 Визначення свіжості м’яса за показником рН
- •Визначення кількості легких жирних кислот
- •Хід роботи:
- •Таблиця 6 Визначення свіжості м’яса за вмістом легких жирних кислот у міліграмах гідроксиду калію
- •Лабораторна робота 9
- •Хід роботи:
- •Визначення свіжості м’яса за кількістю мікробних тіл
- •Орієнтовний перелік питань для підсумкового контролю
- •Лабораторна робота 10
- •Хід роботи:
- •Визначення свіжості риби
- •Орієнтовний перелік питань для підсумкового контролю
- •5. Рекомендована література
- •Навчальне видання Методичні вказівки студентам щодо виконання лабораторних робіт з дисципліни "Мікробіологія"
- •49000, М. Дніпропетровськ, вул. Набережна Леніна, 18.
Хід роботи:
1. Розглянути пристрій апаратів, посуд, прилади та ознайомитися з їх призначенням.
2. Практично освоїти прийоми роботи з апаратурою, посудом і пристосуваннями.
3. Написати звіт про виконану роботу. Лабораторна робота 2
Тема: Пристрій мікроскопа і правила роботи з ним.
Мета роботи: Засвоєння методів мікроскопічних досліджень.
Зміст роботи:
Завдання:Ознайомлення з правилами роботи з мікроскопом.
Дослідження морфологічних та цитологічних особливостей мікроорганізмів, розміри яких вимірюються в мікрометрах (1 мкм = 0,001 мм), можливе лише за допомогою мікроскопів. Світловий мікроскоп – це оптичний прилад, який призначений для вивчення в сильно збільшеному зображенні найдрібніших об'єктів. Його називають світловим, оскільки він забезпечує можливість вивчення об'єктів за допомогою світла, яке проходить через систему лінз мікроскопа у світлому і темному полі, проводити фазовоконтрастну, люмінесцентну, інтерференційно-поляризаційну та інші види мікроскопії.
Оптичний мікроскоп складається з механічної, оптичної систем та системи освітлення.
До механічної частини відноситься основа (башмак) мікроскопа, до нього примикає система, яка регулює положення тубуса (мікро- та макрометричний гвинти), кронштейн конденсора, гвинт для переміщення конденсора, тубусотримач, предметний столик, тубус і револьвер (рис. 6).
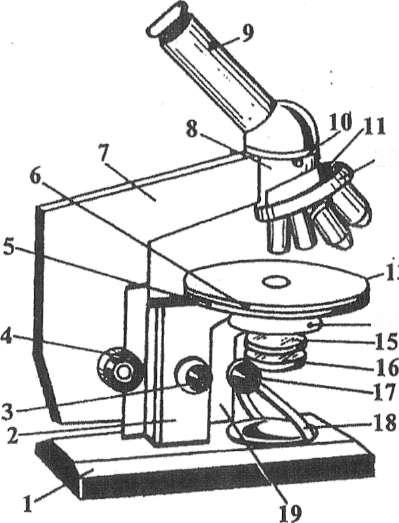
Рис. 6. Мікроскоп з бінокулярною насадкою і дзеркалом (МИКМЕД-1): 1 – основа мікроскопа; 2 – коробка з механізмом мікрометричного фокусування; 3 – мікрометричний гвинт; 4 - макрометричний гвинт; 5,6 – гвинти для переміщення столика, 7 – тубусодержатель; 8 – голівка мікроскопа; 9 – насадка монокулярна (тубус з окуляром); 10 – гвинт для кріплення насадки; 11 – гвинт, фиксирующий револьвер відносно тубуса; 12 – револьвер з об'єктивами; 13 – предметний столик; 14 – гвинт для кріплення конденсора; 15 – конденсор; 16 – додаткова лінза; 17 – руків'я кронштейна; 18 – дзеркало; 19 – кронштейн.
Оптична система мікроскопа складається з основного оптичного вузла – об'єктивів та окулярів.
Оптичний елемент, який створює першу ступінь зображення, називається об'єктивом. Це головна частина мікроскопа, від якої, в основному, залежить загальне збільшення, роздільна здатність та якість зображення. Об'єктив – це система взаємно центрованих лінз (6-10), вмонтованих у металеву оправу (рис. 7).

Рис. 7. Імерсійний об'єктив, який складається з 10 лінз
На верхній стороні оправи є різьба, за допомогою якої об'єктив закріплюється в гнізді револьвера. Сама маленька передня (найближча до об'єкта) лінза називається фронтальною. Це єдина в об'єктиві лінза, яка виконує функцію дійсного збільшення об'єкта. Інші лінзи корегують оптичні недоліки, які виникають при мікроскопії. До таких недоліків відносяться явища сферичної та хроматичної аберацій.
Явище сферичної аберації полягає в тому, що точка предмета проектується не у вигляді точки, а у вигляді більшого чи меншого розміру. При цьому зображення розмивається і стає нечітким. Кривизна полязору призводить до того, що зображення плоского предмета викривлене інеможливо бачити чітко одночасно центр і край зображення.
Хроматична аберація виникає при проходженні через лінзу пучків променів із різною довжиною хвилі. При цьому зображення, яке створюється зеленими променями, не співпадає із зображенням, яке створюється червоними і синіми променями. Як результат – у безкольорового об'єкта з'являється забарвлення.
За ступенем виправлення аберацій об'єктиви поділяють на:
Ахроматичні – прості за будовою системи, в яких хроматична аберація виправлена лише для двох довжин хвиль і має місце залишкове кольорове зображення.
Апохроматичні – більш складні системи, хроматична аберація яких виправлена для трьох довжин хвиль, вони дають безкольорове зображення. Такі об'єктиви використовують для дослідницької роботи.
Планхроматичні і планахроматичні об'єктиви. Це складні оптичні системи, які виправляють кривизну зображення. Вони дають плоске поле зору і використовуються переважно для мікрофотографування.
До цієї групи відносяться також об'єктиви для фазово-контрастної мікроскопії.
Основними характеристиками об'єктива є власне збільшення і числова апертура.
Збільшенням об'єктива називають співвідношення між істинною величиною об'єкта і його уявним зображенням, яке дає лінза. Збільшення залежить від кривизни фронтальної лінзи – чим більша кривизна лінзи, тим коротша фокусна відстань і тим вище збільшення об'єктива. В комплект мікроскопів входить декілька об'єктивів з різним власним збільшенням та відповідною числовою апертурою (табл. 1). Власне збільшення і числова апертура позначаються на оправі об'єктивів.
Апертурою (числовою апертурою) А об'єктива називають синус апертурного кута sin α/2 при вершині конуса світлового потоку, який проходить через об'єкт (рис. 8):
А=sin α/2 (1)
Таблиця 1
Деякі характеристики об’єктивів до мікроскопу „МИКМЕД-1"
|
Система |
Власне збільшення |
Числова апертура |
Робоча відстань, мм |
|
Планахромати | |||
|
Суха |
3,5х |
0,10 |
23,40 |
|
Суха |
4х |
0,10 |
23,40 |
|
Суха |
9х |
0,20 |
13,13 |
|
Суха |
10x |
0,20 |
13,13 |
|
Ахромати | |||
|
Суха |
8x |
0,20 |
8,53 |
|
Суха |
20x |
0,40 |
1,70 |
|
Суха |
40x |
0,65 |
0,41 |
|
Водна імерсія |
40x |
0,75 |
1,64 |
|
Водна імерсія |
85x |
1,00 |
0,18 |
|
Масляна імерсія |
90x |
1,25 |
0,10 |
|
Масляна імерсія |
100x |
1,25 |
0,10 |
|
Апохромати | |||
|
Суха |
10x |
0,30 |
4,80 |
|
Суха |
20x |
0,65 |
0,67 |
|
Масляна імерсія |
60x |
1,00 |
0,22 |
|
Масляна імерсія |
90x |
1,30 |
0,12 |
|
Масляна імерсія |
100x |
1,30 |
0,12 |
О

Рис.
8. Схема ходу променів при різній
величині кута u:
А –
об'єкт; О
–
об'єктив; α –
апертурний кут; u
–
половина апертурного
кута
Це рівняння справедливе, якщо між об'єктом і фронтальною лінзою об'єктива знаходиться повітря (n=1). Якщо перед фронтальною лінзою об'єктива знаходиться речовина з іншим, більш високим показником заломлення (n>1), то при визначенні числової апертури об'єктива sin α/2 множать на величину n:
![]() (2)
(2)
Речовини, які мають n>1 і використовують в мікроскопії, називають імерсійними середовищами (табл. 2).
Таблиця 2
Імерсійні середовища та їх характеристики
|
Речовина |
Показник заломлення |
|
Вода |
1,33302 |
|
Гліцерин |
1,47158 |
|
Кедрова олія |
1,51525 |
|
Монобромфталеїн |
1,65820 |
Таким чином, використання імерсійних середовищ дозволяє підвищити апертуру об'єктива, оскільки їх показник заломлення більше показника заломлення повітря (nпов.=1,0) і наближається до такого скла. При цьому промені світла в оптично однорідному (гомогенному) середовищі не змінюють свого напрямку (рис. 9).
Фронтальна
Рис.
9. Хід променів в мікроскопі:
а –
без імерсії; б –
з імерсією

Для роботи з імерсією були розроблені занурювальні (імерсійні) об'єктиви, які на своїй оправі мають чорну (для об'єктивів з масляною імерсією) або білу (для об'єктивів із водною імерсією) кругову нарізку.
Ще однією характеристикою мікроскопу є його роздільна здатність – найменша відстань між двома крапками (чи рисками) на препараті, які видно окремо. Роздільна здатність оптичного мікроскопа (d) визначається за формулою:
![]() (3)
(3)
де λ– довжина хвилі світла. Видима частина денного світла включає хвилі від 400 до 700 нм (середнє значення – 550 нм); А1 – числова апертура об’єктива (вказується на оправі об’єктива), А2 – числова апертура конденсатора.
Для досягнення найбільшої роздільної здатності з об'єктивом даної апертури, необхідно щоб і конденсор мав таку ж апертуру. Тому при роботі з імерсійними середовищами інколи вводять їх між верхньою лінзою конденсора і предметним склом. Але апертура конденсора, який освічує препарат, не повинна перевищувати апертуру об'єктива В іншому випадку на препарат буде потрапляти надлишкове світло, яке не попаде в об'єктив, що призведе до зменшення контрастності зображення. Якщо ж апертура конденсора менше апертури об'єктива, то його можливості не будуть повністю використовуватися.
Окуляр – є ніби безпосереднім продовженням "лінз" ока людини. Він дає уявне зображення і збільшує його, не виявляючи деталей досліджуваного об'єкта. Окуляр складається з двох лінз – очної (верхньої) та збиральної (нижньої), вмонтованих у металеву оправу. Призначення нижньої лінзи – збирати промені, які йдуть від об'єктива, таким чином, щоб вони пройшли через маленький отвір очної лінзи. Деякі окуляри, окрім очної та збиральної, мають ще декілька лінз із корегуючою функцією. Такі окуляри називають компенсаційними і на них вигравіювана літера "К". На окулярі також вигравіювано їх збільшення – від 4х до 20х.
Завдяки об'єктиву та окуляру отримують збільшене, уявне, зворотне, у відношенні до препарату, зображення предмета в мікроскопі.
Загальне
збільшення мікроскопа![]() (V)
визначається добутком збільшення
окуляра
(Vок)
на збільшення об'єктива
(Vоб):
(V)
визначається добутком збільшення
окуляра
(Vок)
на збільшення об'єктива
(Vоб):
![]() (4)
(4)
Для більш повного використання роздільної здатності оптичного мікроскопа необхідно використовувати оптимальні сполучення об'єктива і окуляра, які дають так зване корисне збільшення.
Система освітлення включає джерело світла, дзеркало та конденсор. У багатьох сучасних мікроскопах джерело світла вмонтоване в мікроскоп. Дзеркало відбиває світло, яке потрапляє на нього, у конденсор. Конденсор збирає промені, що потрапили на нього від дзеркала і спрямовує їх на об'єкт. Спрямування променів здійснюється за допомогою 2-3 короткофокусних лінз, із яких складається конденсор. Його можна переміщувати вгору-вниз за допомогою спеціального гвинта. Для регулювання інтенсивності освітлення конденсор має ірисову (пелюсткову) діафрагму. Забарвлені об'єкти краще розглядати при майже зовсім розкритій діафрагмі, незабарвлені – при зменшеному отворі діафрагми.
Найкращі результати при роботі з мікроскопом можуть бути отримані лише за умови правильного освітлення об'єкта. Найбільш досконалий метод освітлення базується на системі Кьолєра, яка була запропонована у 1893 р.
В залежності від завдань, які стоять перед дослідником, в мікробіологічній практиці використовують мікроскопію у світлому або темному полі, фазово-контрастну, люмінесцентну та електронну мікроскопію.
Мікроскопія у темному полі
Рис.
10.
Хід променів при мікроскопії в темному
полі: об – об'єктив; п – препарат; мі –
масляна імерсія; лк – лінза конденсора;
дт – діафрагма темного поля; пс –
предметне скло

Якщо у препараті є якісь частинки (об’єкти), то косі промені, відбиті конденсором, зустрічаються з цими частинками, заломлюються на них, утворюючи хвилі дифрагованого світла, які поширюються під кутом у різних напрямках і частина з них потрапляє в об'єктив. Як результат – на темному фоні поля зору видно частинки (клітини та ін.), які яскраво світяться.
Мікроскопія в темному полі належить до ультрамікроскопічних методів, оскільки має більшу роздільну здатність (до 0,06-0,02 мкм). Вона дозволяє спостерігати за рухом мікробних клітин, виявляти збудників деяких захворювань (наприклад, лептоспірозів), вивчати мікроорганізми, розміри яких лежать за межами розподільної здатності світлового мікроскопа. Проте в темному полі зору неможливо вивчати внутрішню будову клітини.
Фазово-контрастна мікроскопія
Майже всі живі клітини прозорі, тому промені світла, проходячи через них, не змінюють своєї амплітуди. Але контрастність зображення знаходиться у прямій залежності від ступеня поглинання світла різними структурними елементами об'єкта. Якщо в об'єкті чергуються місця, які сильно й слабо поглинають світло, то воно, проходячи через різні ділянки такого об'єкта, буде різним. Перетворити "фазовий" (неконтрастний) препарат в "амплітудний" (контрастний) можна шляхом фарбування об'єкта (для мікроскопії живих клітин це малопридатне), або знижуючи апертуру конденсора шляхом прикривання його діафрагми, що знижує роздільну здатність мікроскопа.
Метод фазово-контрастної мікроскопії розроблений для спостереження за прозорими об'єктами. Він базується на перетворенні, за допомогою певного оптичного пристрою, фазових змін, які мають місце при проходженні світлової хвилі через об'єкт, у видимі амплітудні.
Якщо в об'єктив звичайного мікроскопа вмонтувати спеціальний диск – фазову пластинку з кільцем (отримують шляхом напилення диска солями рідких металів товщиною в декілька десятих мкм), а в конденсор – кільцеву діафрагму (непроникну для променів світла пластинку із прозорою щілиною у вигляді кільця), так щоб через конденсор і об'єктив проходило лише кільце світла, які потім суміщають із кільцем фазової пластинки об’єктива, то фази світла, що проходять зсуваються (як правило на 1/4 довжини хвилі), фазові зміни переходять в амплітудні, а препарат стає контрастним. Прозорі, при світлопольній мікроскопії препарати, стають контрастними на світлому фоні (позитивний фазовий контраст) або блискучими на темному фоні (негативний фазовий контраст).
Промінь світла, який попадає на прозорий об'єкт, розщеплюється на два – прямий і дифрагований. Прямий промінь А (рис. 11) іде з кільцевої діафрагми, проходить через частинки об'єкта і фокусується на кільці фазової пластинки. Дифрагований промінь Б, проходячи через об'єкт, не попадає на фазову пластинку.
Оптичні шляхи цих двох променів різні. Між ними створюється різниця фаз, яка неозброєним оком не сприймається. Фазовою ж пластинкою ці фазові зміни перетворюються в амплітудні, які сприймаються оком.
Зображення
об’єктів
Конденсатор
Рис.
11.
Хід променів у фазово-контрастному
мікроскопі

Для проведення фазово-контрастної мікроскопії використовують спеціальні фазово-контрастні пристрої (наприклад, типу КФ-4), до комплекту яких входять:
об'єктиви з фазовим кільцем (10х; 20х; 40х; 90х). На оправі об'єктивів вигравіювана літера "Ф";
фазовий конденсор із револьвером і набором кільцевих діафрагм для кожного з об'єктивів;
допоміжний мікроскоп малого збільшення (типу МИР-2);
освітлювач (типу ОИ-19);
світлофільтри, які пропускають зелені промені світла.
Фазово-контрастна мікроскопія не збільшує роздільної здатності оптичного мікроскопа. Вона дозволяє розглядати тонкі структури живих клітин мікроорганізмів, вивчати стадії їх розвитку, процес поділу клітини, виявляти вплив хімічних речовин на мікробну клітину.
Люмінесцентна мікроскопія
Люмінесцентна мікроскопія, як метод, з'явилася ще в 1910 році.
Світло люмінесценції має більшу довжину хвилі, ніж світло, яке збуджує її, і є однією з характерних ознак речовини.
Люмінесценцією називають явище світіння збуджених систем, тобто таких, що утворюються в результаті поглинання різних видів енергії агамами речовин, які входять у систему. В залежності від виду енергії, яка поглинається, розрізняють термолюмінісценцію, хемілюмінесценцію, електролюмінесценцію, фотолюмінісценцію.
Фотолюмінісценцією називають люмінесценцію, яка виникає після попереднього поглинання квантів світлового випромінювання. Частинка починає інтенсивно світитися в результаті поглинання квантів збуджуючого світла. Повертаючись до вихідного стану, система віддає отриману енергію у вигляді світла, довжина якого більша за довжину збуджуючого випромінювання.
Енергія квантів випромінювання зворотно пропорційна довжині хвилі, тому кванти збуджуючого випромінювання завжди мають більше енергії, ніж кванти люмінесцентного світіння.
При феномені люмінесценції проходить певний проміжок часу між поглинанням збуджуючої енергії та емісією люмінесцентного світіння. Якщо цей проміжок часу перевищує 10-4 сек, то таке явище має назву фосфоресценції. Світіння, яке виникає за більш короткий проміжок часу, називають флуоресценцією. Світіння самої речовини об'єкта, опроміненого ультрафіолетовими променями, називають первинною флуоресценцією, або аутофлуоресценцією (власною флуоресценцією). Якщо ж світіння виникає в спеціальній субстанції (у так званих флуорохромах), якою насичений досліджуваний об'єкт, воно називається вторинною флуоресценцією. При флуоресценції об'єкти (клітини) нібито світяться на темному фоні поля зору мікроскопа.
Як флуорохроми для біологічних об'єктів пропонується достатньо велика група органічних сполук. Найбільш поширеними є флуорохроми акридинової групи (акридиновий оранжевий, акридиновий жовтий, коріофосфін, трипафлавін) і флуорохроми тіазолової групи (примулін та ін.). Флуорохроми використовуються, як правило, у водних розчинах при дуже низьких концентраціях (від 1:500 до 1:1 000 000). За здатністю дисоціювати у водних розчинах флуорохроми поділяють на три основні групи:
лужні флуорохроми – акридиновий оранжевий, акридиновий жовтий, аурамін 00, аурофосфін, коріофосфін, трипафлавін, нейтральрот, берберин сульфат;
нейтральні – родамін В1, родамін С і родамін 6-Ж;
кислі – примулін, еозин, еритрозин, уранін, флуоресцин.
Препарати, оброблені флуорохромами, випромінюють у середовищах, які не проявляють люмінесценції під дією короткохвильових променів – у воді, гліцерині, вазеліновій олії або фізіологічному розчині.
Особливістю люмінесцентної мікроскопії є необхідність роботи з імерсійними рідинами (і середовищами), які позбавлені власної люмінесценції при дії ультрафіолетових і синьо-фіолетових променів. Імерсійні олії, які використовуються для звичайної мікроскопії, проявляють сильну люмінесценцію блакитного або жовто-зеленого кольору, яка маскує світіння препарату. Випускають олії для роботи з покривними скельцями і без них. У тих випадках, коли фабрична олія відсутня, допускається використання деяких замінників: диметилового ефіру ортофталієвої кислоти (диметил фталат, який використовується для боротьби з комарами); метил фенілового ефіру (анізол); вазелінової олії, перевіреної на відсутність люмінесценції, із додаванням α-монобромнафталіну для досягнення необхідного значення коефіцієнта заломлення (1,51). Недоліком диметилфталату є дещо гірша передача оранжевого й червоного кольорів світіння через відсутність задовільної корекції, дисперсії.
Добрі результати дає використання об'єктивів гліцеринової й водної імерсії (бідистильована вода), які дозволяють обійтись без спеціальних імерсійних рідин.
Як найпростіші середовища для "заключення" препаратів можуть бути використані суміш гліцерину з фосфатним буфером (9 ч нелюмінесціюючого гліцерину + 1 ч 0,001 М фосфатного буфера) і вода. Полівініловий спирт, полістирол, акриловий клей, гумісироп, цукровий сироп також можуть бути використані для "заключення" постійних препаратів.
У будові флуоресцентного мікроскопа обов'язкова наявність таких двох елементів:
– сильного джерела ультрафіолетового світла:
– фільтрів, які затримують видиму частину світла.
Оптична схема люмінесцентного мікроскопа відрізняється від звичайної джерелом світла (частіше використовують ртутно- кварцові лампи ДРШ-250), а для затримки променів з довжиною хвилі більшою, ніж ультрафіолетові, і короткохвильових променів видимої області світла на шляху між джерелом випромінювання й препаратом встановлюють спеціальні світлофільтри. Бактеріальні клітини, оброблені флуорохромами, мають вигляд структур, які світяться на темному фоні поля зору мікроскопа.
Характер люмінесценції у різних видів мікроорганізмів різний. Окремі компоненти мікробної клітини одного й того ж виду неоднаково зв'язують і адсорбують флуорохроми, результатом чого є різниця кольорів та інтенсивності світіння. Так, акридиновий оранжевий при низьких концентраціях і певному значенні рН зв'язується з ДНК у вигляді зелених мономерів, а з РНК – у вигляді червоних структур, які дають різне світіння в ультрафіолетовому світлі.
Люмінесцентна мікроскопія дозволяє спостерігати об'єкти, розміри яких знаходяться за межами роздільної здатності при мікроскопії у світлому полі. Крім того, вона дає можливість вивчати зміни окремих структур клітини при різних їх функціональних станах.
Електронна мікроскопія
Принцип електронної мікроскопії полягає в тому, що електромагнітне поле впливає на пучок електронів аналогічно до того, як скляна лінза впливає на промінь світла. Електронний промінь характеризується властивостями електромагнітного випромінювання з дуже малою довжиною хвилі. Якщо електрони прискорені в електричному полі з напругою 100 кВ, то довжина хвилі буде лише 0,04 нм, тобто приблизно в 10 000 разів менше, ніж у видимого світла. Відповідно і роздільна здатність електронного мікроскопу на декілька порядків вища, ніж у світлопольного.
Шлях електронів у трансмісивному (просвічуючому) електронному мікроскопі подібний до шляху променів видимого світла у світловому мікроскопі. Пучок електронів, що виходить з електронної пушки проходить через ряд електромагнітних лінз. Конденсорна лінза збиває пучок електронів на препараті, а декілька збільшувальних лінз створюють збільшене зображення. Зображення проектується на флуорокуючий екран. Оскільки повітря перешкоджає руху електронів, то весь шлях електронного пучка відбувається у високому вакуумі. Так як електрони мають низьку здатність проникнення, в електронному мікроскопі досліджують лише ультратонкі зрізи товщиною до 100 нм.
У трансмісивному електронному мікроскопі контраст зумовлюється тим, що електрони по різному розсіюються на різних ділянках препарату, причому ефективність їх розсіювання залежить від кількості атомів та їх маси. Оскільки до складу біологічних матеріалів входять у більшості атоми з невеликою масою, то контрастність таких матеріалів невелика. Її підвищують за допомогою напилення солями важких металів.
Як світловий, так і електронний трансмісивний мікроскоп дають плоске зображення. Модифікація електронного мікроскопу – скануючий електронний мікроскоп, дозволяє отримувати тривимірне зображення поверхні досліджуваних об'єктів. В такому мікроскопі об'єкт, покритий тонким шаром важкого металу, сканується вузьким пучком електронів (електронним зондом) подібно до того, як це відбувається у телевізійній трубці. Електрони, що надходять від тієї точки об'єкта, на яку потрапляє скануючий пучок, збираються колектором і за допомогою підсилювача створюється зображення на екрані електронно-променевої трубки. Контраст зумовлено тим, що кількість відбитих об'єктом вторинних електронів пропорційна куту між електронним пучком і поверхнею об'єкта, що дозволяє виявити його просторову структуру.
Матеріали та обладнання:мікроскоп, предметні стекла.
