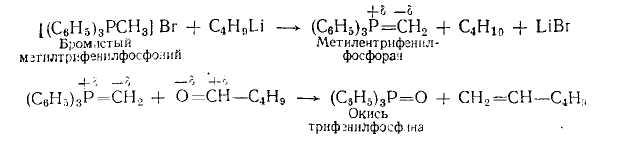- •1.2.Общие вопросы теории химического строения и реакционной способности органических соединений
- •1S22s22p2 или 1s22s22pх 2p y
- •2S 2Px 2Py 2Pz
- •2S 2Px 2Py 2Pz
- •Тема 2. Предельные углеводороды
- •2.3. Физические свойства предельных углеводородов
- •2.4. Химические свойства предельных углеводородов
- •2.5. Получение предельных углеводородов
- •Тема 3. Этиленовые углеводороды
- •3.1. Состояние углерода в этиленовых углеводородах, природа двойной связи
- •3.2. Изомерия, номенклатура углеводородов ряда этилена
- •3.4. Физические свойства
- •3.5. Химические свойства
- •Тема 4. Ацетиленовые углеводороды
- •4.1. Номенклатура углеводородов ряда ацетилена
- •4.2. Физические свойства ацетиленовых углеводородов
- •4.3. Способы получения
- •4.4. Химические свойства
- •Тема 5. Механизм реакций органических соединений
- •5.1. Гомолитическое и гетеролитическое расщепления
- •5.2. Факторы, определяющие реакционную способность молекулы
- •5.3. Классификация органических соединений
- •Тема 6. Ароматические углеводороды
- •6.1. Строение ароматических углеводородов
- •6.2. Номенклатура и изомерия
- •6.3. Способы получения
- •6.4. Химические свойства
- •6.5. Химические свойства гомологов бензола
- •Тема 7. Спирты
- •7.1. Номенклатура и изомерия спиртов
- •7.2. Физические свойства спиртов
- •7.3. Способы получения
- •7.4. Химические свойства
- •7.5. Многоатомные спирты
- •Тема 8. Фенолы
- •8.1. Номенклатура фенолов
- •8.2. Физические свойства
- •8.3. Способы получения
- •8.4. Химические свойства
- •Тема 9. Альдегиды. Кетоны
- •9.1. Номенклатура и изомерия
- •9.2. Способы получения
- •9.3. Физические свойства
- •9.4. Химические свойства
- •Тема 10. Органические кислоты. Амиды
- •10.1. Классификация карбоновых кислот
- •10.2. Номенклатура и изомерия
- •10.3. Способы получения
- •10.4. Физические свойства
- •10.5. Строение
- •10.6. Химические свойства
- •10.7. Амиды
- •Тема 11. Сложные эфиры
- •11.1. Номенклатура и изомерия
- •11.2. Физические свойства сложных эфиров
- •11.3. Химические свойства сложных эфиров
- •Тема 12. Жиры
- •12.1. Номенклатура и изомерия
- •12.2. Физические свойства
- •12.3. Химические свойства
- •Тема 13. Азотсодержащие органические соединения
- •13.1. Нитросоединения
- •13.2. Азотсодержащие гетероциклические соединения
- •13.3. Шестичленные гетероциклы
- •13.4. Соединения с пятичленным циклом
- •13.5. Нуклеиновые кислоты
- •13.6. Амины
- •13.7. Аминокислоты
- •13.8. Белки
- •Тема 14. Углеводы
- •14.1. Номенклатура
- •14.2. Моносахариды
- •14.3. Олигосахариды
- •14.4. Полисахариды
3.2. Изомерия, номенклатура углеводородов ряда этилена
Структурная изомерия начинается в этом ряду, как и в ряду предельных углеводородов, с углеводорода с четырьмя атомами углерода, однако число изомеров у этиленовых углеводородов значительно больше.
Наряду с изомерией, связанной со строением углеродной цепи, в ряду олефинов наблюдается структурная изомерия по положению двойной связи в цепи. Кроме того, в ряду олефинов имеет место пространственная (геометрическая) так называемая цис-транс-изомерия.
Цис-изомеры содержат определенные (в частном случае одинаковые) атомы или группы атомов при углеродах с двойной связью по одну сторону от этой связи, транс-изомеры – по разные стороны:

Существование геометрической цис-транс-изомерии в ряду олефинов связано с тем, что π-связь не допускает свободного вращения по оси σ-связи между двумя углеродными атомами.
Переход одного геометрического изомера в другой возможен лишь при высоких температурах, когда энергия теплового движения достаточна для ослабления π-связи, при освещении благодаря поглощению световой энергии или при действии катализаторов, также ослабляющих π-связь.
Названия олефинов по систематической номенклатуре образуются из названий аналогично построенных парафинов заменой суффиксов -ан на -ен.
Причем цифрой показывают положение двойной связи (после какого атома идет двойная связь).
За главную цепь принимается самая длинная цепь с двойной связью.
Нумерация углеродных атомов начинается с того конца цепи, к которому двойная связь ближе.
Для первого члена ряда сохраняется и тривиальное название – этилен. В разговорной речи иногда употребляются тривиальные и старые рациональные названия олефинов Так, например, олефины часто называют как алкилзамещенные родоначальника ряда – этилена или по соответствующему парафину, меняя окончание -ан на –илен.
Первые четыре предельных углеводорода с нормальной (без разветвлений, когда каждый атом углерода связан непосредственно не более чем с двумя другими атомами углерода) цепью имеют эмпирические названия:
этилен С2Н4
пропилен С3Н6
бутилен С4Н8
(пентилен) амилен С5Н10
Каждый последующий углеводород в гомологическом ряду отличается от предыдущего на гомологическую разницу СН2 .

Непредельные углеводородные радикалы называют добавлением к корню суффикса -енил:
СН2=СН- этенил,
СН3–СН=СН - пропенил,
СН2=СН–СН2 – 2-пропенил
Укоренились некоторые эмпирические названия:
СН2=СН- винил,
СН2=СН–СН2 – аллил,
СН2=С–СН3 изопропенил,
СН3–СН=СН–СН2- кротил
3.3. Способы получения
Олефины встречаются в некоторых нефтях. Особенно велико их содержание в канадской нефти. В чистом виде из нефти выделены углеводороды от С6Н12 до С13Н26.
1. Первые четыре члена ряда олефинов получаются в технике в чистом состоянии разгонкой под давлением или при пониженной температуре газообразной части продуктов крекинга нефтяных дистиллятов, а также из газов коксования (этилен, пропилен).
В связи с тем, что некоторые олефины для технических целей нужны в больших количествах, чем они могут быть выделены из газов крекинга и других промышленных источников, в технике получает все большее распространение метод получения их дегидрогенизацией предельных углеводородов. Катализатором этого процесса обычно является специальным образом приготовленная окись хрома:

Наиболее обычным способом получения олефинов в лабораторных условиях является дегидратация (отщепление воды) спиртов:

В качестве катализаторов дегидратации используются различные кислоты (серная, фосфорная), кислые соли (KHSO4), полупятиокись фосфора, окись алюминия, соли алюминия и др.
В зависимости от природы спирта требуется применять различные условия дегидратации. Особенно легко дегидратируются третичные спирты: часто они отщепляют воду уже при перегонке.
Порядок отщепления воды в большинстве случаев определяется правилом Зайцева: при образовании воды наиболее легко отщепляется водород от соседнего наименее гидрогенизированного атома углерода. Этот водород наиболее подвижен:

В процессе дегидратации часто происходит перемещение двойной связи и строение полученного углеводорода не отвечает строению исходного спирта. Так, например, при дегидратации изоамилового спирта обычно получаются три углеводорода:

3. Олефины часто получают отщеплением галогеноводородов или галогенов от галогенопроизводных.
Моногалогенопроизводные дают олефины при действии щелочей (дегидрогалогенирование):

Обычно для этих целей применяется спиртовой раствор КОН и/или NaOH. Однако в этом случае может пойти побочная реакция – образование простого эфира:

Поэтому иногда отщепляют галогеноводород с помощью твердой измельченной щелочи или органических оснований – диметиланилина или хинолина.
Направление дегидрогалогенировання при этом соответствует уже рассмотренному правилу Зайцева:
![]()
Для получения олефинов иногда используют метод отщепления галогенов от вицинальных дигалогенопроизводных. Чаще всего это делают с помощью цинковой пыли или цинковых стружек в водноспнртовом растворе:

4. В некоторых случаях ацетиленовые углеводороды с определенным строением получаются легче, чем отвечающие им по строению олефины. В таких случаях последние получают частичным «селективным» гидрированием ацетиленовых углеводородов, например над палладиевым катализатором:
![]()
5. В последнее время для синтеза олефинов с конечной двойной связью очень часто используется реакция Виттига: