
- •1.2.Общие вопросы теории химического строения и реакционной способности органических соединений
- •1S22s22p2 или 1s22s22pх 2p y
- •2S 2Px 2Py 2Pz
- •2S 2Px 2Py 2Pz
- •Тема 2. Предельные углеводороды
- •2.3. Физические свойства предельных углеводородов
- •2.4. Химические свойства предельных углеводородов
- •2.5. Получение предельных углеводородов
- •Тема 3. Этиленовые углеводороды
- •3.1. Состояние углерода в этиленовых углеводородах, природа двойной связи
- •3.2. Изомерия, номенклатура углеводородов ряда этилена
- •3.4. Физические свойства
- •3.5. Химические свойства
- •Тема 4. Ацетиленовые углеводороды
- •4.1. Номенклатура углеводородов ряда ацетилена
- •4.2. Физические свойства ацетиленовых углеводородов
- •4.3. Способы получения
- •4.4. Химические свойства
- •Тема 5. Механизм реакций органических соединений
- •5.1. Гомолитическое и гетеролитическое расщепления
- •5.2. Факторы, определяющие реакционную способность молекулы
- •5.3. Классификация органических соединений
- •Тема 6. Ароматические углеводороды
- •6.1. Строение ароматических углеводородов
- •6.2. Номенклатура и изомерия
- •6.3. Способы получения
- •6.4. Химические свойства
- •6.5. Химические свойства гомологов бензола
- •Тема 7. Спирты
- •7.1. Номенклатура и изомерия спиртов
- •7.2. Физические свойства спиртов
- •7.3. Способы получения
- •7.4. Химические свойства
- •7.5. Многоатомные спирты
- •Тема 8. Фенолы
- •8.1. Номенклатура фенолов
- •8.2. Физические свойства
- •8.3. Способы получения
- •8.4. Химические свойства
- •Тема 9. Альдегиды. Кетоны
- •9.1. Номенклатура и изомерия
- •9.2. Способы получения
- •9.3. Физические свойства
- •9.4. Химические свойства
- •Тема 10. Органические кислоты. Амиды
- •10.1. Классификация карбоновых кислот
- •10.2. Номенклатура и изомерия
- •10.3. Способы получения
- •10.4. Физические свойства
- •10.5. Строение
- •10.6. Химические свойства
- •10.7. Амиды
- •Тема 11. Сложные эфиры
- •11.1. Номенклатура и изомерия
- •11.2. Физические свойства сложных эфиров
- •11.3. Химические свойства сложных эфиров
- •Тема 12. Жиры
- •12.1. Номенклатура и изомерия
- •12.2. Физические свойства
- •12.3. Химические свойства
- •Тема 13. Азотсодержащие органические соединения
- •13.1. Нитросоединения
- •13.2. Азотсодержащие гетероциклические соединения
- •13.3. Шестичленные гетероциклы
- •13.4. Соединения с пятичленным циклом
- •13.5. Нуклеиновые кислоты
- •13.6. Амины
- •13.7. Аминокислоты
- •13.8. Белки
- •Тема 14. Углеводы
- •14.1. Номенклатура
- •14.2. Моносахариды
- •14.3. Олигосахариды
- •14.4. Полисахариды
Тема 14. Углеводы
ПЛАН
14.1. Номенклатура.
14.2. Моносахариды.
14.3. Олигосахариды.
14.4. Полисахариды.
14.1. Номенклатура
Углеводами называют природные органические соединения, имеющие, как правило, общую формулу СmН2nОn (Сm(Н2O )n). Исключение составляют дезоксисахара, которые имеют общую формулу СmН2n +2On.
В зависимости от способности к гидролизу все углеводы делятся на:
моносахариды – углеводы, молекулы которых не подвержены гидролизу;
олигосахариды – углеводы, из молекул которых при гидролизе образуется от двух до десяти одинаковых или различных моносахаридов;
полисахариды – углеводы, из молекул которых при гидролизе образуется от десятков тысяч и выше одинаковых или различных моносахаридов.
Углеводы – распространенный в природе класс органических соединений.
В растениях углеводы образуются в результате реакции фотосинтеза из CO2 и Н2О:

14.2. Моносахариды
Моносахариды по числу углеродных атомов в молекуле делятся на: триозы (С3Н6О3), тетрозы (С4Н8О4), пентозы (С5Н10О5), гексозы (С6Н12О6), гептозы (С7Н14О7) и октозы (С8Н16О8).
Моносахариды – дифункциональные соединения, так как в составе каждой молекулы содержатся несколько гидроксильных групп и одна карбонильная. В зависимости от природы карбонильной группы (альдегидная или кетонная) моносахариды делятся на альдозы и кетозы. Так, моносахарид гексоза существует в виде двух структурных изомеров – альдогексозы (I) (глюкоза) и кетогексозы (II) (фруктоза):

Изомерия моносахаридов обусловлена: 1) наличием альдегидной или кетонной группы; 2) наличием асимметрических атомов углерода; 3) существованием таутомерии.
Моносахариды, как и другие соединения с асимметрическими атомами углерода, существуют в виде двух оптических изомеров – D- и L-форм. Отнесение к D- и L-формам производят по расположению гидроксильной группы у атома углерода, соседнего с первичной спиртовой группировкой:
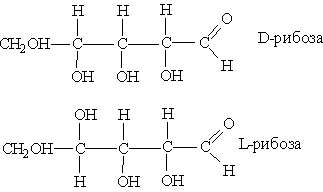
Все моносахариды существуют в виде двух таутомерных форм: открытой, или ациклической, и закрытой, или циклической. Циклическая форма образуется в результате внутримолекулярного взаимодействия альдегидной (кетонной) группировки с одним из гидроксидов.
Наибольшей устойчивостью обладают шести- и пятичленные циклы, называемые соответственно пиранозными и фуранозными циклами. Схема образования пиранозного цикла:

Атом водорода гидроксильной группы присоединяется к атому кислорода альдегидной группировки за счет разрыва p -связей. При этом образуется так называемый полуацетальный или гликозидный гидроксил. После переноса атома водорода от гидроксильной группы на альдегидную атом кислорода соединяется с атомом углерода с образованием цикла. В результате циклизации в молекуле моносахарида появляется дополнительный асимметрический атом углерода.
Образующиеся циклические формы отличаются друг от друга расположением полуацетального гидроксила. К α -изомерам относят моносахариды, у которых гликозидный гидроксил находится под плоскостью кольца, к β -изомерам – моносахариды, у которых полуацетальный гидроксил находится над плоскостью кольца.
Получение:
1. Выделение моносахаридов, встречающихся в овощах и фруктах.
2. Гидролиз полисахаридов.
3. Синтез гексоз из формальдегида:
![]()
Реакция была впервые изучена А.М. Бутлеровым. В результате реакции образуется смесь различных трудноразделяемых гексоз.
Физические свойства. Моносахариды – бесцветные кристаллические вещества, плавящиеся с разложением, хорошо растворимые в воде, в растворах вращающие поляризованный свет, сладкие на вкус.
Химические свойства. Многообразие химических свойств моносахаридов объясняется их дифункциональностью.
1. Реакции образования эфиров. Моносахариды способны образовывать простые и сложные эфиры. Наиболее легко происходит замещение полуацетального (гликозидного) гидроксила:

Простые эфиры получили название гликозидов. В более жестких условиях возможно алкилирование и по другим оставшимся гидроксильным группам.
Моносахариды способны образовывать сложные эфиры как с минеральными, так и с карбоновыми кислотами, например:

Большое значение имеют эфиры фосфорной кислоты рибозы и дезоксирибозы, являющиеся структурными фрагментами РНК и ДНК.
2. Реакция комплексообразования с гидроксидом меди (II). При взаимодействии свежеосажденного гидроксида меди (II) с моносахаридами происходит растворение гидроксида с образованием комплекса синего цвета.
3. Окислительно-восстановительные реакции (ОВР). При каталитическом гидрировании моносахаридов происходит восстановление карбонильной группы до спиртового гидроксила.

Бромная вода окисляет альдегидную группировку до карбоксильной:

ОВР с оксидом серебра (I) и гидроксидом меди (II) используют как качественные реакции на альдозы и кетозы:


Кетозы дают те же самые реакции, так как в щелочной среде происходит их изомеризация в альдозы.
4. Реакция брожения. Моносахариды (например, глюкоза) способны расщепляться в зависимости от природы фермента до этанола, масляной или молочной кислоты:

Отдельные моносахариды.
Глюкоза – бесцветное кристаллическое вещество, сладкое на вкус, хорошо растворимое в воде.
В организме человека и животных глюкоза подвергается ферментативному окислению, конечными продуктами которого являются оксид углерода (IV) и вода: организме человека и животных глюкоза подвергается ферментативному окислению, конечными продуктами которого являются оксид углерода (IV) и вода:
![]()
Фруктоза – структурный изомер глюкозы. Кристаллическое вещество, хорошо растворимое в воде, более сладкое, чем глюкоза. В свободном виде содержится в мёде и фруктах.
Химические свойства фруктозы обусловлены наличием кетонной и пяти гидроксильных групп.
Дезоксирибоза – бесцветное кристаллическое вещество, хорошо растворимое в воде. В виде фуранозной формы входит в состав ДНК. Как и другие моносахариды, дезоксирибоза в растворе существует в ациклической и циклической формах, способна образовывать простые и сложные эфиры, принимает участие в ОВР и реакциях комплексообразования.

Рибоза – бесцветное кристаллическое вещество, хорошо растворимое в воде. В виде фуранозной формы входит в состав РНК. Химические свойства рибозы обусловлены наличием альдегидной и гидроксильных групп. При восстановлении рибозы образуется спирт – рибит НОСН2–(СНОН)3–СН2ОН, а при окислении – рибоновая кислота НОСН2–(СНОН)3–СООН. В растворе рибоза существует в ациклической и циклической формах:

Получают рибозу гидролизом мононуклеотидов.
