
- •1.2.Общие вопросы теории химического строения и реакционной способности органических соединений
- •1S22s22p2 или 1s22s22pх 2p y
- •2S 2Px 2Py 2Pz
- •2S 2Px 2Py 2Pz
- •Тема 2. Предельные углеводороды
- •2.3. Физические свойства предельных углеводородов
- •2.4. Химические свойства предельных углеводородов
- •2.5. Получение предельных углеводородов
- •Тема 3. Этиленовые углеводороды
- •3.1. Состояние углерода в этиленовых углеводородах, природа двойной связи
- •3.2. Изомерия, номенклатура углеводородов ряда этилена
- •3.4. Физические свойства
- •3.5. Химические свойства
- •Тема 4. Ацетиленовые углеводороды
- •4.1. Номенклатура углеводородов ряда ацетилена
- •4.2. Физические свойства ацетиленовых углеводородов
- •4.3. Способы получения
- •4.4. Химические свойства
- •Тема 5. Механизм реакций органических соединений
- •5.1. Гомолитическое и гетеролитическое расщепления
- •5.2. Факторы, определяющие реакционную способность молекулы
- •5.3. Классификация органических соединений
- •Тема 6. Ароматические углеводороды
- •6.1. Строение ароматических углеводородов
- •6.2. Номенклатура и изомерия
- •6.3. Способы получения
- •6.4. Химические свойства
- •6.5. Химические свойства гомологов бензола
- •Тема 7. Спирты
- •7.1. Номенклатура и изомерия спиртов
- •7.2. Физические свойства спиртов
- •7.3. Способы получения
- •7.4. Химические свойства
- •7.5. Многоатомные спирты
- •Тема 8. Фенолы
- •8.1. Номенклатура фенолов
- •8.2. Физические свойства
- •8.3. Способы получения
- •8.4. Химические свойства
- •Тема 9. Альдегиды. Кетоны
- •9.1. Номенклатура и изомерия
- •9.2. Способы получения
- •9.3. Физические свойства
- •9.4. Химические свойства
- •Тема 10. Органические кислоты. Амиды
- •10.1. Классификация карбоновых кислот
- •10.2. Номенклатура и изомерия
- •10.3. Способы получения
- •10.4. Физические свойства
- •10.5. Строение
- •10.6. Химические свойства
- •10.7. Амиды
- •Тема 11. Сложные эфиры
- •11.1. Номенклатура и изомерия
- •11.2. Физические свойства сложных эфиров
- •11.3. Химические свойства сложных эфиров
- •Тема 12. Жиры
- •12.1. Номенклатура и изомерия
- •12.2. Физические свойства
- •12.3. Химические свойства
- •Тема 13. Азотсодержащие органические соединения
- •13.1. Нитросоединения
- •13.2. Азотсодержащие гетероциклические соединения
- •13.3. Шестичленные гетероциклы
- •13.4. Соединения с пятичленным циклом
- •13.5. Нуклеиновые кислоты
- •13.6. Амины
- •13.7. Аминокислоты
- •13.8. Белки
- •Тема 14. Углеводы
- •14.1. Номенклатура
- •14.2. Моносахариды
- •14.3. Олигосахариды
- •14.4. Полисахариды
9.4. Химические свойства
Химические свойства альдегидов и кетонов обусловлены присутствием в их молекуле активной карбонильной группы, в которой двойная связь сильно поляризована в силу большой электроотрицательности кислорода (>С==О).
В результате на карбонильном атоме углерода (карбанион) возникает заметный положительный заряд. Поэтому для альдегидов и кетонов характерны реакции присоединения по двойной связи С=О. Большинство из них протекает как нуклеофильное присоединение.
Кроме реакции присоединения по карбонильной группе, для альдегидов характерны также реакции с участием a -атомов водорода, соседних с карбонильной группой. Их реакционная способность связана с электроноакцепторным влиянием карбонильной группы, которое проявляется в повышенной полярности связи С–Н. Это приводит к тому, что альдегиды, в отличие от кетонов, легко окисляются. Их взаимодействие с аммиачным раствором оксида серебра является качественной реакцией на альдегиды.
Реакции нуклеофильного присоединения. Альдегиды и кетоны, обладая электрофильным центром, способны вступать во взаимодействие с нуклеофильными реагентами. Для оксосоединений наиболее характерны реакции, протекающие по механизму нуклеофильного присоединения обозначаемому АN (от англ. addition nucleophilic).
1. Реакция с циановодорооной (синильной) кислотой. Реакция имеет важное значение в органической химии. Во-первых, в результате реакции можно удлинить углеродную цепь; во-вторых, продукты реакции – гидроксинитрилы – служат исходными соединениями для синтеза гидроксикарбоновых кислот:
![]()
2. Взаимодействие со спиртами. Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали и ацетали.
Полуацеталями называются соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную группы. Ацетали – это соединения, содержащие при одном атоме углерода две алкоксильные группы:


Реакцию получения ацеталей широко используют в органических синтезах для “защиты” активной альдегидной группы от нежелательных реакций:

Особенно важное значение подобные реакции имеют в химии углеводов.
3. Присоединение гидросульфитов служит для выделения альдегидов из смесей с другими веществами и для получения их в чистом виде, поскольку полученное сульфопроизводное очень легко гидролизуется:
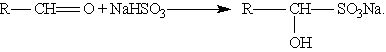
4. Присоединение реактива Гриньяра. В органическом синтезе чрезвычайно часто используется реактив Гриньяра – одно из простейших металлоорганических соединений.
При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра:
![]()
где R – алкильный или арильный радикал, Х – галоген.
а) Взаимодействием реактива Гриньяра с формальдегидом можно получить практически любой первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньяра гидролизуют водой:
![]()
б) При использовании любых других алифатических альдегидов могут быть получены вторичные спирты:
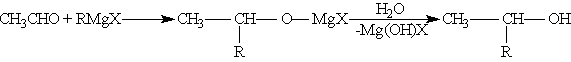
в) Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты:

5. Восстановление оксосоединений.
6. Реакции окисления. Альдегиды и кетоны по-разному относятся к действию окислителей. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты. Для их окисления можно использовать такие мягкие окислители, как оксид серебра и гидроксид меди (II).
Кетоны к действию окислителей инертны, в частности они не окисляются кислородом воздуха. Кетоны реагируют только с очень сильными окислителями, способными разорвать углерод-углеродные связи в их молекуле.
а) Одной из качественных реакций для обнаружения альдегидной группы является реакция “серебряного зеркала” – окисление альдегидов оксидом серебра.
Оксид серебра всегда готовят непосредственно перед опытом, добавляя к раствору нитрата серебра раствор гидроксида аммония:

В растворе аммиака оксид серебра образует комплексное соединение, при действии которого на альдегид происходит окислительно-восстановительная реакция. Альдегид окисляется в соответствующую кислоту (точнее, в ее аммонийную соль), а комплексный катион восстанавливается до металлического серебра, которое дает блестящий налет на стенках пробирки – “серебряное зеркало”:

б) Другая качественная реакция на альдегиды заключается в окислении их гидроксидом меди (II). При окислении альдегида светло-голубой гидроксид меди (II) превращается в желтый гидроксид меди (I) при комнатной температуре. Если подогреть раствор, то гидроксид меди (I) превращается в оксид меди (I) красного цвета, который плохо растворим в воде и выпадает в осадок:

7. Реакции поликонденсации.
Поликонденсация – это процесс образования высокомолекулярных соединений из низкомолекулярных, сопровождающийся выделением побочного вещества (воды, аммиака, хлороводорода и др.).
При полимеризации в отличие от поликонденсации выделения побочных веществ не происходит. Продукты поликонденсации (исключая побочные вещества) так же, как и продукты полимеризации, называются полимерами.
В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолоформальдегидные смолы, из которых получают пластмассы – фенопласты (бакелиты). Фенопласты – важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготовляются большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали.
