
- •1.2.Общие вопросы теории химического строения и реакционной способности органических соединений
- •1S22s22p2 или 1s22s22pх 2p y
- •2S 2Px 2Py 2Pz
- •2S 2Px 2Py 2Pz
- •Тема 2. Предельные углеводороды
- •2.3. Физические свойства предельных углеводородов
- •2.4. Химические свойства предельных углеводородов
- •2.5. Получение предельных углеводородов
- •Тема 3. Этиленовые углеводороды
- •3.1. Состояние углерода в этиленовых углеводородах, природа двойной связи
- •3.2. Изомерия, номенклатура углеводородов ряда этилена
- •3.4. Физические свойства
- •3.5. Химические свойства
- •Тема 4. Ацетиленовые углеводороды
- •4.1. Номенклатура углеводородов ряда ацетилена
- •4.2. Физические свойства ацетиленовых углеводородов
- •4.3. Способы получения
- •4.4. Химические свойства
- •Тема 5. Механизм реакций органических соединений
- •5.1. Гомолитическое и гетеролитическое расщепления
- •5.2. Факторы, определяющие реакционную способность молекулы
- •5.3. Классификация органических соединений
- •Тема 6. Ароматические углеводороды
- •6.1. Строение ароматических углеводородов
- •6.2. Номенклатура и изомерия
- •6.3. Способы получения
- •6.4. Химические свойства
- •6.5. Химические свойства гомологов бензола
- •Тема 7. Спирты
- •7.1. Номенклатура и изомерия спиртов
- •7.2. Физические свойства спиртов
- •7.3. Способы получения
- •7.4. Химические свойства
- •7.5. Многоатомные спирты
- •Тема 8. Фенолы
- •8.1. Номенклатура фенолов
- •8.2. Физические свойства
- •8.3. Способы получения
- •8.4. Химические свойства
- •Тема 9. Альдегиды. Кетоны
- •9.1. Номенклатура и изомерия
- •9.2. Способы получения
- •9.3. Физические свойства
- •9.4. Химические свойства
- •Тема 10. Органические кислоты. Амиды
- •10.1. Классификация карбоновых кислот
- •10.2. Номенклатура и изомерия
- •10.3. Способы получения
- •10.4. Физические свойства
- •10.5. Строение
- •10.6. Химические свойства
- •10.7. Амиды
- •Тема 11. Сложные эфиры
- •11.1. Номенклатура и изомерия
- •11.2. Физические свойства сложных эфиров
- •11.3. Химические свойства сложных эфиров
- •Тема 12. Жиры
- •12.1. Номенклатура и изомерия
- •12.2. Физические свойства
- •12.3. Химические свойства
- •Тема 13. Азотсодержащие органические соединения
- •13.1. Нитросоединения
- •13.2. Азотсодержащие гетероциклические соединения
- •13.3. Шестичленные гетероциклы
- •13.4. Соединения с пятичленным циклом
- •13.5. Нуклеиновые кислоты
- •13.6. Амины
- •13.7. Аминокислоты
- •13.8. Белки
- •Тема 14. Углеводы
- •14.1. Номенклатура
- •14.2. Моносахариды
- •14.3. Олигосахариды
- •14.4. Полисахариды
7.5. Многоатомные спирты
Двух- и трехатомные спирты получают теми же способами, что и одноатомные. В качестве исходных соединений могут быть использованы алкены, галогенопроизводные и другие соединения.
Общим методом синтеза гликолей является окисление алкенов перманганатом калия в нейтральной или щелочной среде.
Для двух- и трехатомных спиртов характерны основные реакции одноатомных спиртов. Однако в их химических свойствах есть особенности, обусловленные присутствием в молекуле двух и более гидроксильных групп.
Кислотность многоатомных спиртов выше, чем одноатомных, что объясняется наличием в молекуле дополнительных гидроксильных групп, обладающих отрицательным индуктивным эффектом. Поэтому многоатомные спирты, в отличие от одноатомных, реагируют с щелочами, образуя соли. По аналогии с алкоголятами соли двухатомных спиртов называют гликолятами, а трехатомных – глицератами.
При взаимодействии гидроксида меди (II) с глицерином и другими многоатомными спиртами происходит растворение гидроксида и образуется комплексное соединение синего цвета. Эта реакция используется для обнаружения многоатомных спиртов, имеющих гидроксильные группы при соседних атомах углерода –СН(ОН)–СН(ОН)–:

Для многоатомных спиртов характерно образование сложных эфиров. В частности, при реакции глицерина с азотной кислотой в присутствии каталитических количеств серной кислоты образуется тринитрат глицерина (нитроглицерин):

Тема 8. Фенолы
ПЛАН
8.1. Номенклатура фенолов.
8.2. Физические свойства.
8.3. Способы получения.
8.4. Химические свойства.
8.1. Номенклатура фенолов
Названия фенолов составляют с учетом том того, что для родоначальной структуры по правилам ИЮПАК сохранено тривиальное название “фенол”. Нумерацию атомов углерода бензольного кольца начинают от атома, непосредственно связанного с гидроксильной группой (если она является старшей функцией), и продолжают в такой последовательности, чтобы имеющиеся заместители получили наименьшие номера.
Монозамещенные производные фенола, например метилфенол (крезол), могут существовать в виде трех структурных изомеров – орто-, мета- и пара-крезолов.
8.2. Физические свойства
Фенолы в большинстве своем – кристаллические вещества (мета-крезол – жидкость) при комнатной температуре. Они обладают характерным запахом, довольно плохо растворимы в воде, но хорошо растворяются в водных растворах щелочей. Фенолы образуют прочные водородные связи и имеют довольно высокие температуры кипения.
8.3. Способы получения
1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
![]()
2. Получение из ароматических сульфокислот, реакция проводится при сплавлении сульфокислот со щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:

8.4. Химические свойства
В фенолах р-орбиталь атома кислорода образует с ароматическим кольцом единую p -систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О–Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов).
Кроме того, в результате такого взаимного влияния в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара-положениях в реакциях электрофильного замещения (галогенирования, нитрования, поликонденсапии и т. д.):
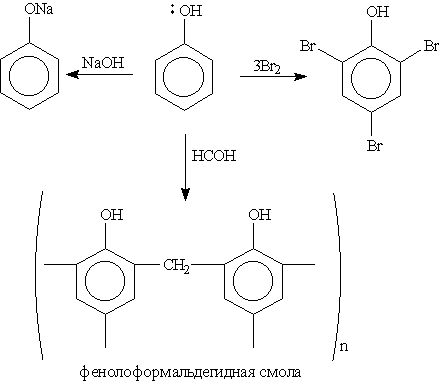
1. Кислотные свойства фенола проявляются в реакциях со щелочами (сохранилось старинное название “карболовая кислота”):
![]()
Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол – такая реакция доказывает, что фенол – более слабая кислота, чем угольная и сернистая:
![]()
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода.
2. Образование сложных эфиров. В отличие от спиртов фонолы не образуют сложных эфиров при действии на них карбоновых кислот; для этого используются хлорангидриды кислот:
![]()
3. Галогенирование. При действии на фенол бромной воды образуется осадок 2,4,6-трибромфенола:

Это – качественная реакция для обнаружения фенола.
4. Нитрование. Под действием 20%-ной азотной кислоты фенол легко превращается в смесь орто- и пара-нитрофенолов. Если нитровать фенол концентрированной азотной кислотой, то образуется 2,4,6-тринитрофенол – сильная кислота (пикриновая).
5. Окисление. Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон:

