
- •Криоскопия Лабораторные работы №5 и №13 Разбавленные растворы
- •Лабораторная работа № 5
- •Определение молярной массы растворенного вещества
- •Криоскопическим методом
- •Приборы и материалы
- •Описание прибора
- •Порядок выполнения работы
- •При выполнении работы необходимо:
- •Лабораторная работа № 13 Определение изотонического коэффициента и степени электролитической диссоциации электролитов по методу криоскопии Приборы и материалы
Раствором
называется система, образованная не
менее чем двумя компонентами, и способная
в известных пределах к непрерывному
изменению состава. Состав раствора или
его концентрацию чаще всего выражают: в
молях растворенного вещества на один
литр раствора (молярная концентрация,
С); в
молях растворенного вещества на 1000 г
растворителя (моляльная концентрация,
m); в
молярных долях, (Х); в
весовых процентах (w).
Наиболее
простым закономерностям подчиняются
идеальные растворы, образуемые
веществами, сходными по химическому
составу и физическим свойствам.
Образование идеального раствора при
любом соотношении компонентов не
сопровождается сжатием или расширением
(V
= 0) а также выделением или поглощением
теплоты (Н
= 0). Отклонения от идеальности вызываются
химическими (ассоциация, диссоциация,
сольватация и т.п.) и физическими (влияние
различия молекулярных объемов и сил
взаимодействия молекул) эффектами.
Свойствами идеального раствора не
обладает ни один реальный раствор, за
исключением растворов оптически
активных изомеров и смесей, состоящих
из компонентов, различающихся по
изотопному составу, однако, очень многие
растворы практически ведут себя как
идеальные. Это, прежде всего, бесконечно
разбавленные растворы, т.е. такие, в
которых содержание растворенного
вещества очень мало по сравнению с
содержанием растворителя.
При
равновесии между жидкостью и паром
число испаряющихся молекул в единицу
времени равно числу конденсирующихся.
Если в летучей жидкости растворить
небольшое количество какого-либо
нелетучего вещества, то концентрация
растворителя понизится, в соответствии
с этим понизится и число испаряющихся
молекул, т.е. давление насыщенного пара.
Оно пропорционально содержанию
растворителя в растворе, которое обычно
выражают в виде молярной доли (Х0)
в бинарном растворе:
где
Тогда
Р =
const
х0.
Коэффициент
пропорциональности определяется из
начального условия: если х0
=1,
то Р0
= const,
т.е. постоянная равна давлению чистого
компонента.
Давление
насыщенного пара1
растворителя над раствором равно
давлению Р0
пара над
чистым растворителем, умноженному на
его молярную долю в растворе:
Р
= Р0 .
х0
= Р0 . (1
– Х) (II,
1)
Решив
уравнение относительно х,
получим:
Это
уравнение, установленное Раулем
эмпирическим путем, показывает, что
при
постоянной температуре относительное
понижение давления насыщенного пара
растворителя над раствором равно
молярной доле растворенного вещества.
Соотношения
между давлением насыщенного пара и
температурой для растворителя и
растворов различной концентрации
представлены на рис.1.
Кривая
ОА, характеризующая равновесие чистой
жидкости с ее насыщенным паром, начинается
в точке замерзания жидкости (Т0).
Ниже
этой температуры жидкость не существует,
и пар находится в равновесии с твердой
фазой. Кривая FO
дает зависимость давления насыщенного
пара над твердой фазой от температуры
Математически
кривые ОА и FO
для равновесий жидкостьгаз
(а) и
кристаллгаз
(б) выражаются
уравнением Клаузиуса - Клапейрона:
или
для уравнений (а)
и (б)
соответственно:
Кривая
FO
(кривая возгонки) всегда идет круче,
чем кривая ОА равновесия (а),
т.к. теплота возгонки больше теплоты
испарения.
Точка
замерзания жидкости характеризуется
равновесным сосуществованием жидкой,
кристаллической и газовой фаз. При этом
химические потенциалы во всех трех
фазах должны быть равны, и, следовательно,
должны быть равны и давления насыщенного
пара над жидкой и кристаллическими
фазами (т.е. точка замерзания должна
лежать на пересечении кривых
ОА и FO).
При
замерзании разбавленного раствора из
него выкристаллизовывается чистый
растворитель (исключение составляют
твердые растворы). Поэтому в точке
замерзания давление пара над раствором
должно равняться давлению пара над
кристаллическим растворителем. При
температуре замерзания чистого
растворителя Т0
давление пара над раствором Р
(точка В) ниже, чем над твердым растворителем
Р0
(точка О), и равновесия между твердой
фазой (льдом) и раствором нет. Равновесие
может быть достигнуто лишь при более
низкой температуре (Т1),
а именно: в точке пересечения кривых
ВС и FO
(точка В). Чем выше концентрация
растворенного вещества (кривая DE),
тем ниже температура замерзания раствора
(Т2).
По
мере выделения из раствора кристаллов
растворителя концентрация растворенного
вещества в растворе повышается, а
температура замерзания раствора все
больше понижается.
Температурой
замерзания раствора
данной концентрации следует считать
температуру, при которой начинается
кристаллизация
растворителя.
Итак,
понижение химического потенциала
растворителя в растворе приводит к
понижению давления пара компонентов
раствора, что вызывает понижение
температуры замерзания раствора, и,
как следует из рис.1, должно приводить
одновременно к повышению температуры
кипения раствора при постоянном
давлении.
Чистый
растворитель или раствор начинает
кипеть при такой температуре, при
которой давление пара растворителя
над чистым растворителем или раствором
будет равно внешнему давлению Р
(в обычных условиях P
= 1 атм = 1,0133105
Па). Из закона Рауля следует, что давление
пара растворителя над идеальным
раствором меньше, чем над чистым
растворителем при той же температуре.
Зависимость давления пара растворителя
от температуры над чистым растворителем
и над раствором показана на рис. 1.
Криоскоп
– прибор для криоскопических измерений Термометр
Бекмана Термометр
со шкалой от - 10С
до 10 – 50С Дистиллированная
вода Лед,
соль для охлаждения Задача
(выдается инженером) Краткая
теория к работе Криоскопия
– это метод физико-химического
исследования, основанный на измерении
понижения температуры замерзания
раствора по сравнению с температурой
замерзания чистого растворителя. Для
разбавленного идеального бинарного
раствора понижение температуры
замерзания пропорционально моляльности
раствора и зависит от природы растворителя
Т
= Т0
– Т = K
.
m (IV)
где
Т0
– температура
замерзания растворителя,
Т
- температура замерзания раствора,
m
– моляльная концентрация раствора,
К
– коэффициент пропорциональности.
Если
m
= 1, т.е. 1 моль вещества растворен в 1000 г
растворителя, то Т
= К, поэтому
постоянную К
в уравнении (IV)
называют моляльным
понижением температуры замерзания
раствора,
или криоскопической
постоянной.
Она зависит только от природы растворителя
и не зависит от концентрации раствора
и химического состава растворенного
вещества.
Для экспериментального определения К
следует измерить понижение температуры
замерзания в разбавленных растворах,
а затем пересчитать эти данные на 1
моль:
Криоскопическую
постоянную можно вычислить теоретически,
зная температуру замерзания растворителя
Т0,
его молярные массу М0
и теплоту плавления Нпл.,
по уравнению:
Криоскопические постоянные некоторых
растворителей приведены в таблице: Растворитель К,
К/моль
Тзам.,
К Вода
1,86
273,2 Бензол 5,10 278,7 Нитробензол 6,90 278,9 Фенол 7,80 313,2 Камфора 40,00 451,2
Если из раствора при замерзании выпадают
кристаллы чистого растворителя, то
понижение температуры замерзания
раствора используют для определения
молярной массы растворенного вещества
(М).
Если
в q0
г растворителя растворено q г вещества,
то моляльность полученного раствора
(m)
равна:
Подставляя
это выражение в формулу (1), получим:
откуда молярная
масса растворенного вещества (М) равна:
Массы
q0
и q
находят взвешиванием; К
(для данного растворителя) – постоянная
величина. Следовательно, опыт сводится
к определению Т,
т.е. к определению понижения температуры
замерзания раствора, приготовленного
из q0
г растворителя
и q
г растворенного вещества.
Криоскопический
метод применим только к разбавленным
растворам, вследствие чего для Т
получаются очень небольшие значения.
При выполнении этой работы пользуются
термометрами, позволяющими делать
отсчет с точностью.
Для
криоскопических измерений применяется
прибор, предложенный Бекманом, схема
которого приведена на рис.2.
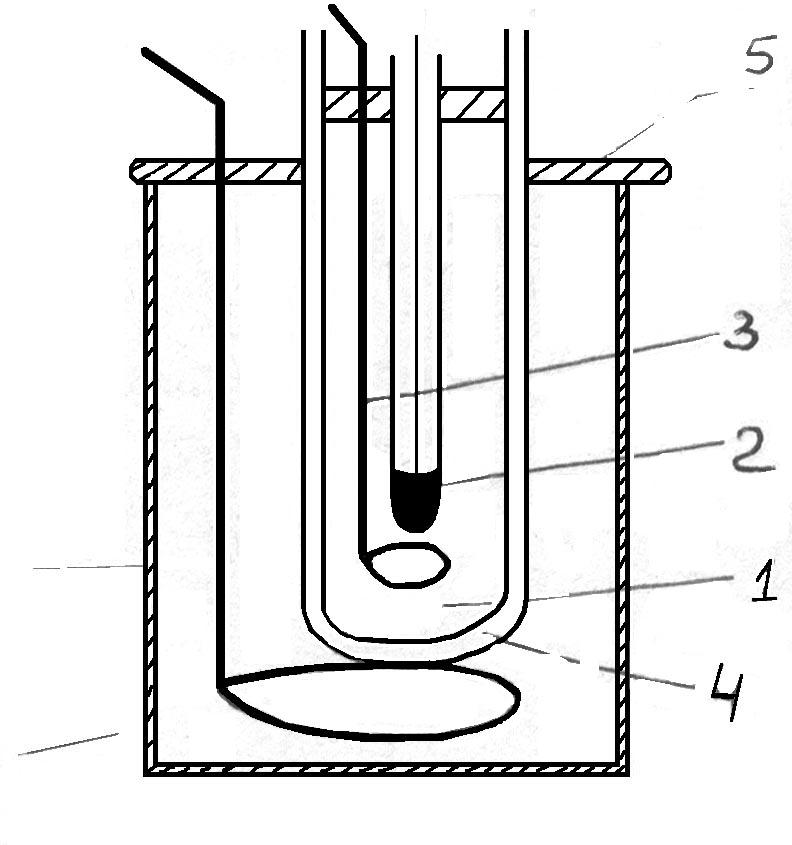
Основная часть прибора – стеклянная
пробирка-криоскоп (1), в которую во время
опыта заливают исследуемый раствор
или растворитель. Пробирка (1) плотно
закрывается пробкой, через отверстие
которой вставляются термометр (2) и
мешалка (3) из тонкой проволоки, конец
которой загнут в виде кольца, свободно
охватывающего термометр. Пробирка
бόльшего размера (4) служит воздушной
“рубашкой”, в которую может помещаться
пробирка (1) во время опыта и используется
для более равномерного охлаждения.
Собранный прибор через отверстие в
крышке погружают в толстостенный стакан
(5), который предварительно должен быть
заполнен охладительной смесью (вода с
толченым льдом и солью). Мешалку (6) из
толстой проволоки используют для
перемешивания охладительной смеси.
Рис.
2. Прибор для криоскопических измерений
В
криоскопических опытах для измерения
температуры используются приборы
особого вида - термометры Бекмана
(дифференциальные, или разностные
термометры). Они отличаются от обычного,
во-первых, большой шкалой (точной),
позволяющей наблюдать изменение
температуры до 0,0050
и, во-вторых, вторым запасным ртутным
резервуаром, при помощи которого можно
изменять количество ртути в основном
(нижнем) резервуаре и тем значительно
расширить диапазон измеряемых температур.
Шкала такого термометра, имеющего длину
25-30 см, поделена всего на 50
с отметками между ними десятых и сотых
долей. Переводя некоторое количество
ртути из нижнего резервуара в верхний,
или добавляя ртуть из верхнего в нижний,
всегда можно настроить термометр так,
чтобы температура замерзания данного
растворителя попала бы на середину
этой условной шкалы (между 40
и 20).
Особая конструкция этого термометра
требует специальной настройки, которую
осуществляет лаборант
или инженер.
Подготовленный
к работе термометр Бекмана следует
держать в стакане со льдом.
При вынимании
изо льда термометр нагревается, ртутный
столбик поднимается в капилляре до
места соединения
его
с запасным
резервуаром,
поэтому нужно следить за тем, чтобы
капля ртути не сорвалась и не упала в
запасной резервуар, т.к. это собьёт
настройку термометра и повлечет за
собой повторение всех операций в работе.
Стакан
(5) заполняют на 2/3
охладительной смесью (вода, толченый
лед, соль). Обычным термометром измеряют
температуру охладительной смеси,
которая должна в течение всего опыта
поддерживаться от – 40
до – 50
С. При более низкой температуре
охладительной смеси получается излишне
быстрое охлаждение жидкости и резкое
ее переохлаждение, что приводит к
неправильному определению температуры
замерзания.
В
чистую пробирку (1) цилиндром отмеряют
точный объем дистиллированной воды
до такого уровня, чтобы нижний резервуар
термометра Бекмана был полностью
погружен в нее, но не касался дна
пробирки (не более 20 мл). Затем пробирку
с водой охлаждают, поместив ее в стакан
с охладительной смесью.
Определение
приближенного значения температуры
кристаллизации растворителя (Т0).
Термометр
Бекмана из стакана со льдом переносят
в пробирку с охлажденной водой, укрепляют
с помощью пробки, в которую вставлена
мешалка (3) и помещают криоскоп в стакан
с охладительной смесью. Воду в пробирке
и охладительную смесь все время
перемешивают с помощью мешалок (3) и
(6), наблюдая за ртутным столбиком и
появления кристаллов льда в пробирке.
Температура начала выпадения кристаллов
льда чистой воды и будет приближенным
значением температуры кристаллизации
растворителя Т0.
Затем пробирку с водой вынимают из
охладительной смеси, нагревают рукой
при перемешивании мешалкой (3) до полного
растворения кристаллов. Следить
за тем, чтобы ртутная капля не оторвалась
в запасной резервуар!
Определив приблизительную температуру
кристаллизации воды, измерения повторяют
2 – 3 раза до получения воспроизводимых
результатов. Не следует допускать
длительного замораживания воды, чтобы
термометр не “вмерз” в лед. В этом
случае вынимать термометр из пробирки
можно только после расплавления льда,
т.к. в противном случае из-за примерзания
нижнего резервуара со ртутью к стенке
криоскопа термометр может быть поврежден.
Определение
точного значения температуры
кристаллизации растворителя (Т0)
проводят из переохлажденной жидкости.
Если бы переохлаждения не было, в
особенности при определении температуры
замерзания растворов, которая понижается
по мере увеличения концентрации
раствора вследствие кристаллизации
растворителя. Поэтому при отсутствии
переохлаждения ртуть в капилляре
непрерывно и равномерно опускалась
бы ниже точки замерзания раствора, и
температуру замерзания раствора нельзя
было бы точно отсчитать. Для растворов
температурой замерзания считается
температура начала
кристаллизации чистого растворителя.
Погружают
пробирку с водой в охладительную смесь
и, помешивая, охлаждают до температуры
Т0+20.
После достижения этой температуры
мешалку (3) поднимают вверх и закрепляют
в таком положении, чтобы она не находилась
в растворе. Помешивая мешалкой (6),
охлаждают пробирку до температуры Т0
+ 0,50
и быстро надевают «рубашку», снова
погружают собранный прибор в охладительную
смесь и продолжают охлаждение, помешивая
только охладительную смесь мешалкой
(6) до температуры Т0
– 1,50
(т.е. ниже истинной температуры
замерзания). После этого вызывают
кристаллизацию переохлажденной воды
с помощью мешалки (3). Из-за выделяющейся
при этом теплоты кристаллизации
температура резко повышается до значения
истинной температуры кристаллизации
некоторое время остается постоянной.
Отмечают максимальное показание
термометра Т0,
которое соответствует истинной
температуре замерзания воды.
Снова
расплавляют выпавшие кристаллы и
повторяют опыт не менее трех раз,
добиваясь расхождения в значениях Т0
не более 0,0050.
После этого находят среднее значение
истинной температуры замерзания Т0.
Определение
температуры замерзания раствора.
От
инженера или преподавателя получают
исследуемое вещество для определения
его молекулярной массы.
Берут
точную навеску исследуемого вещества
q1
= 1 г сначала на технических, затем, на
аналитических весах, растворяют его в
воде, находящейся в пробирке и охлаждают
раствор в стакане с охладительной
смесью. Затем в охлажденный раствор
вносят термометр Бекмана и определяют
сначала приблизительную (Т)
(см. п.3), а затем истинную (Т) температуру
замерзания раствора.
Так
как кристаллизация, как правило,
начинается после некоторого переохлаждения
раствора, температура при этом быстро
повышается, достигая истинной температуры
замерзания, соответствующей раствору
данной концентрации, а затем, в связи
с выделением кристаллов растворителя
(воды) концентрация раствора увеличивается,
что ведет к понижению температуры
замерзания – поэтому
не следует
допускать длительного замораживания
раствора.
Истинную
температуру замерзания раствора
определяют не менее трех раз (до получения
воспроизводимых результатов). Таким
образом, получают понижение температуры
замерзания раствора: Т0
– Т = Т
Результаты
отдельных измерений и окончательный
результат определения молярной массы
записать в таблицу по образцу.
Оформление
результатов работы.
Исследуемая
система
Температура
замерзания Понижение
температуры замерзания раствора Т
= Т0
– Т
приближенная
точная
средняя
Н2О 1
2
3
Раствор 1
2
3
Растворитель
– вода (Н2О),
масса растворителя q0,
масса растворенного вещества q
= 1г.
Вычисление молярной
массы растворенного вещества проводят
по формуле (4).
Следить,
чтобы термометр не касался стенок
пробирки.
Следить, чтобы кристаллы льда были
полностью расплавлены, иначе не удастся
переохладить раствор.
Следить,
чтобы в охладительной смеси было
достаточное количество льда, а
температура ее была не выше (–30
С) и не ниже (–50
С). Не
прекращать помешивание (не слишком
энергично) охладительной смеси во
время замера показаний термометра.
Криоскоп
– прибор для криоскопических измерений Термометр
Бекмана Термометр
со шкалой от - 10С
до 10 – 50С Дистиллированная
вода Лед,
соль для охлаждения Электролиты:
0,1 m
KCl;
0,1 m
BaCl2;
0,1 m
CH3COOH
Краткая теория
к работе
Было
замечено, что электролиты имеют более
высокое осмотическое давление, а также
замерзают при более низкой температуре
и кипят при более высокой, чем неэлектролиты
в растворах равных концентраций.
Вант-Гофф пришел к выводу, что электролиты
ведут себя так, словно содержат больше
частиц, чем это соответствует числу
молекул растворенного вещества.
Электролиты диссоциируют на катионы
и анионы. Поэтому в растворах электролитов
содержится больше частиц, чем в растворах
неэлектролитов. Осмотические и
криоскопические закономерности зависят
от общей концентрации частиц, а не от
их природы. Следовательно, процесс
электролитической диссоциации приводит
к отклонениям от законов Вант-Гоффа и
Рауля: Pэксп.
Pтеор.,
Тэксп.
Ттеор.,
где Pэксп.
и Тэксп.
- экспериментально наблюдаемые для
растворов электролитов осмотические
давление и температура замерзания.
Согласно Вант-Гоффу:
где
i
– поправочный
коэффициент, который Вант-Гофф назвал
изотоническим.
Зная
изотонической коэффициент (i)
и число ионов, образуемое одной молекулой
электролита (),
можно вычислить степень электролитической
диссоциации .
Возьмем
1 моль KCl,
состоящий из N
= 6,021023
молекул. Отношение количества
диссоциированных молекул к общему
числу растворенных молекул до диссоциации
называется по Аррениусу степенью
диссоциации .
Пусть степень диссоциации ,
тогда в недиссоциированном виде
останется 1 –
моль его или N(1
– )
молекул и появляется
моль или N
ионов К+
и
моль или N
ионов Cl-,
в сумме всего (1 – )
+
+
= 1 +
моль или N(1
+ )
частиц. Следовательно, изотонический
коэффициент (множитель Вант-Гоффа),
показывающий во сколько раз больше
частиц в растворе по сравнению с
ожидаемым по формуле вещества
(диссоциации), равен
В
случае BaCl2
в недиссоциированном виде остается 1
-
моль, образуется
моль ионов Ba++
и 2
моль ионов Cl-,
поэтому в сумме получим (1 - )
+ 2
+
= (1 + 2)
в растворе, следовательно,
В
общем случае, когда молекула распадается
на
частиц в растворе, найдем 1 -
моль недиссоциированного вещества и
ионов, в сумме 1 + (
– 1)
частиц, тогда i
= 1 + (
-1)
или
Согласно
классическим представлениям, данное
уравнение применимо для любых (как
слабых, так и сильных) электролитов.
Согласно учению о сильных электролитах,
принимающему для них
=1, это соотношение описывает только
введение для слабых электролитов.
Данные экспериментов
заносят в таблицу: Электролит m,
(моль/1000г
Н2О)
tз
tэксп.
tтеор.=
K
m KCl
BaCl2
CH3COOH
О
проделанной работе составить отчет,
содержащий следующее:
Название и цель
работы
приборы и материалы
Краткая теория
Ход определения
и запись данных
Выводы
Вопросы к работе Что
такое криоскопия? Запишите основное
уравнение криоскопии. При каких условиях
это уравнение можно использовать для
вычисления молярной массы растворенного
вещества? Когда основное уравнение
криоскопии даст неверные результаты
для идеального жидкого раствора? Что
называется криоскопической постоянной?
Как можно экспериментально определить
и теоретически рассчитать ее величину? Как
пройдут кривые зависимости давления
пара раствора нелетучего вещества
различных концентраций, если их нанести
на диаграмму состояния чистого
растворителя? Можно ли на этой диаграмме
показать, как изменяется температура
замерзания и кипения раствора в
зависимости от его концентрации? Какими
соображениями необходимо руководствоваться
при выборе растворителя для
криоскопического метода определения
молярной массы растворенного вещества? Какие
свойства растворов называются
коллигативными? Перечислите их и
напишите соответствующие уравнения. Назовите
метода определения молярных масс
неэлектролитов и степени диссоциации,
основанные на изучении свойств
разбавленных растворов. Изотонический
коэффициент Вант-Гоффа, методы его
определения. От чего зависит величина
изотонического коэффициента?
20Криоскопия Лабораторные работы №5 и №13 Разбавленные растворы
![]() ,
, ![]() ,
, ![]() (I),
(I),![]() и
и
![]() -
молярные доли растворителя и растворенного
вещества;
-
молярные доли растворителя и растворенного
вещества; ![]() и
и
![]() -
числа молей растворителя и растворенного
вещества.
-
числа молей растворителя и растворенного
вещества.![]() (II,
2)
(II,
2)
![]() (III),
(III), ![]() (III,
а) и
(III,
а) и  (III,
б)
(III,
б)Лабораторная работа № 5
Определение молярной массы растворенного вещества
Криоскопическим методом
Приборы и материалы
![]() ,
m
= 1 моль/1000 г р-ля,
,
m
= 1 моль/1000 г р-ля,
![]() (V)
(V)![]() (V
a)
(V
a)
![]() (VI)
(VI)![]() ,
,![]() (VII)
(VII)Описание прибора
Порядок выполнения работы
![]() ,
где К = 1,86
,
где К = 1,86При выполнении работы необходимо:
Лабораторная работа № 13 Определение изотонического коэффициента и степени электролитической диссоциации электролитов по методу криоскопии Приборы и материалы
![]() (VIII),
(VIII),![]() ,
откуда степень диссоциации
= i
– 1.
,
откуда степень диссоциации
= i
– 1.![]() или
или![]() .
.![]()
![]()
![]()
1
2 19
3 18
4 17
5 16
6 15
7 14
8 13
9
12
10 11
