
- •Тема № 6. Природа органических соединений. Их классификация и номенклатура.
- •1. Органическая химия как наука
- •2. Основные источники органического материала
- •3. Классификация и номенклатура о.С.
- •Тема 8. Углеводороды нефти. Гомологи метана, этана, Этилена, ацетилена и бензола
- •1. Алканы. Понятие про изомерию.
- •2. Непредельные углеводороды: гомологи этилена и ацетилена
- •3. Ароматические углеводороды (арены). Бензол.
- •3. Дегидроциклизация алканов.
- •4. Декарбоксилирований солей ароматических кислот.
3. Классификация и номенклатура о.С.
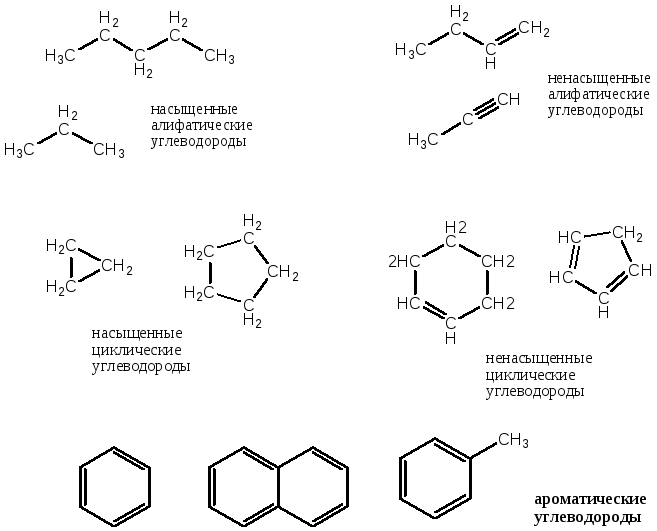
О.с. классифицируют в зависимости от строения углеродного скелета.

Алициклические (алифатические) о.с. имеют открытую цепь углеродных атомов. Среди этих о.с. различают: насыщенные и ненасыщенные. К насыщенным относят такие, которые имеют только одинарные связи С – С. В молекулах ненасыщенных соединений имеются двойные связи С = С или (и) тройные С ≡ С.

Циклические о.с. делятся на карбо- и гетероциклические. Первые имеют цикл образованный только атомами углерода, а в цикл последних могут входить гетероатомы: O, N, S, P. Все эти о.с. также могут быть насыщенными и ненасыщенными, в зависимости от того какими связями соединяются атомы цикла.

Для каждого из приведенных классов о.с. принята отдельная классификация в зависимости от наличия тех ил других функциональных групп.
Функциональная группа – группировка различных атомов, которая определяет основные свойства о.с.
Таблица - Классификация о.с. по функциональной группе
|
№ |
Название класса |
Общая формула / Функциональная группа |
|
1 |
Галогенпроизводные |
R – Hal |
|
2 |
Спирты. фенолы |
R – OH |
|
3 |
Тиоспирты |
R – SH |
|
4 |
Простые эфиры |
R – O – R1 |
|
5 |
Сульфиды |
R – S – R1 |
|
6 |
Гидроперекиси |
R – OOH |
|
7 |
Пероксиды |
R – O – O – R1 |
|
8 |
Альдегиды |
|
|
9 |
Кетоны |
|
|
10 |
Карбоновые кислоты |
|
|
11 |
Сложные эфиры |
|
|
12 |
Амиды |
|
|
13 |
Нитросоединения |
R – NO2 |
|
14 |
Амины |
R – NH2 |
Тема 8. Углеводороды нефти. Гомологи метана, этана, Этилена, ацетилена и бензола
План:
1. Алканы. Понятие про изомерию. Циклоалканы (нафтены).
2. Непредельные углеводороды: гомологи этилена и ацетилена
3. Ароматические углеводороды.
1. Алканы. Понятие про изомерию.
Основным компонентом природного сырья и, одновременно, первым классом о.с. являются углеводороды – соединения углерода с водородом.
Углеводороды бывают:
|
2. Циклические:
|
Например:
Насыщенность обусловлена отсутствием в молекуле углеводорода кратных (двойных и тройных связей).
Если в молекуле углеводорода (например, метана) заменить один из атомов водорода на другой не водородный атом или группу атомов то образуются представители других классов о.с. (см. тему 7).
К основным классам органических соединений относят:
1. Галогенпроизводные – R-Hal (F, Cl, Br, I)
2. Спирты – R-ОН и эфиры – R-О-R;
3. Кислоты – R-С(=О)ОН;
4. Альдегиды – R-С(=О)H и кетоны – R-С(=О)-R;
5. Амины – R-NH2, амиды – R-С(=О)NH2, нитрилы – R-С≡N
Для представления реального строения о.с. важное значение имеет информация про взаимное расположение атомов в молекуле относительно друг друга. Это дает возможность прогнозировать физические и химические свойства вещества. Для определения строения молекулы необходимо точно знать качественный и количественный состав ее – т.е. брутто-формулу (молекулярную формулу). При этом часто одни и те же соединения которым отвечает одна и та же брутто-формула проявляют совершенно различные химические и физические свойства.
Например формула С2Н6О соответствует как этиловому спирту С2Н5ОН (+78.30С) так и диметиловому эфиру СН3-О-СН3 (-240С), собственно говоря совершенно разным соединением.
Из структурных формул становится ясно, что разница в свойствах связана с неодинаковой последовательностью расположения атомов в молекулах этих веществ.
Различное расположение атомов в молекуле вызывает появление весьма важного для органических соединений (и всего живого вообще) явления – изомерии.
Изомерия-явление существования соединений с одинаковой брутто-формулой, но с различными физическими и химическими свойствами.
К алифатическим углеводородам относят: алканы, алкены и алкины:
Алканами (парафины или придельные углеводороды) называют углеводороды с открытой (нецикличной) цепью, в молекулах которых атомы углерода связаны между собой одинарными σ-связями. Алканы образуют гомологический ряд, в котором каждый член отличается на структурную единицу -СН2- (гомологическая разница). Общая формула алканов CnH2n+2, простейший представитель – метан СН4 (т. к. -161.50С). Соответственно следующим гомологом будет этан СН3-СН3 и т.д.
Таблица - алканы
|
Количество атомов углерода |
Название |
Формула |
|
1 |
Метан |
СН4 |
|
2 |
Этан |
С2Н6 |
|
3 |
Пропан |
С3Н8 |
|
4 |
Бутан |
С4Н10 |
|
5 |
Пентан |
С5Н12 |
|
6 |
Гексан |
С6Н14 |
|
7 |
Гептан |
С7Н16 |
|
8 |
Октан |
С8Н18 |
|
9 |
Нонан |
С9Н20 |
|
10 |
Декан |
С10Н22 |
Однако алканы, которым отвечает одна и та же молекулярная формула имеют различное строение углеводородной цепи, например:
Бутан - С4Н10, можно нарисовать двумя способами
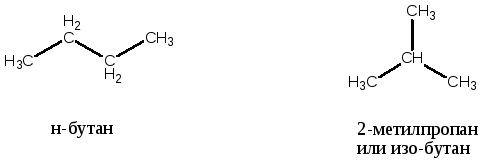
Это углеводороды различного строения. А значит и свойства их различны. Для пентана - С5Н12 можно нарисовать уже три варианта цепочки углеродных атомов:
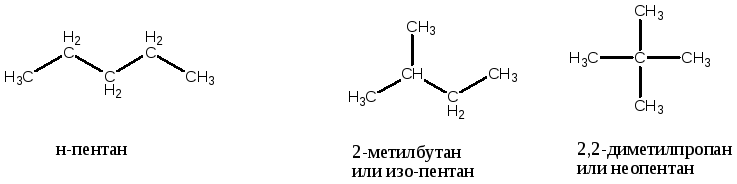
Два бутана, так же как и три пентана являются по отношению друг к другу изомерами. А само явление называется изомерией.
Изомерия бывает разных видов. В данном случае для алканов характерна структурная изомерия углеводородной цепи – обусловлена различной последовательностью атомов углерода в молекуле.
С увеличением числа углеродов в молекулярной формуле алкана – число его структурных изомеров резко возрастает. Например, для декана их уже 75, а для алкана с формулой С40Н82 – более 62 триллионов. Конечно, же не все изомеры существуют в действительности в природе, многие были получены синтетически, подавляющее большинство – только теоретически.
Основные физические свойства алканов.
Первые четыре представителя алканов С1-С2 – при о.у. газы, С5-С15 – жидкости, начиная с С16- твердые вещества. Увеличение молекулярных масс приводит к возрастанию температуры кипения и плавления, причем разветвленные изомеры кипят при более низкой температуре чем соответствующие им алканы нормального строения, а парные алканы плавятся при более высокой температуре чем непарные.
Основные химические свойства алканов.
Алканы являются сравнительно инертными химическими соединениями, особенно метан, поэтому, например, жидкие алканы служат растворителями для химических реакций. С увеличением числа углеродных атомов реакционная способность несколько увеличивается.
1. Характерным химическим свойством алканов является радикальное замещение атомов водорода на галоген (Cl2, Br2)
CH4+Cl2=CH3Cl+HCl,
реакция легко может протекать далее с образованием хлористого метилена (CH2Cl2), хлороформа (CHCl3) и четыреххлористого углерода (CCl4) - растворители.
2. Окисление алканов кислородом воздуха при высоких температурах – горение:
CH4+2О2=CО2+2H2О, +802.5 кДж
При горении низших алканов выделяется большое количество энергии.
3. Крекинг алканов – термическое превращение алканов при температуре (500-7000С) обычно сопровождающееся расщеплением С-С связей и образованием более коротких углеродных цепей. Такое расщепление может сопровождаться дегидрированием с образованием кратных С=С связей.

4. Каталитический крекинг – применяют для получения разветвленных алканов (моторное топливо) и ненасыщенных углеводородов:

3. Алканы являются сырьем для получения мономеров для синтеза различных полимеров (пластмасс, синтетических волокон, каучука).
Циклоалканы (нафтены) – это циклические насыщенные углеводороды. Их названия такие же, как и у алканов, но с добавлением приставки цикло-.

Если атом водорода в алкане заменить на функциональную группу:

то образуются соответственно циклические спирты, альдегиды, кислоты, амины, амиды и т.д. Эти соединения также во множестве присутствуют в нефти и углях.





