
- •Механизмы реакций.
- •Механизм реакции радикального замещентия (sr)
- •Sr in vivo (в организме) пероксидное окисление липидов (пол). Липиды – компоненты клеточных мембран. В результате пол: изменения в обмене веществ, образование канцерогенных соединений. Механизм пол:
- •Механизм реакции электрофильного присоединения (ае)
- •Механизм реакции
- •Механизм реакции электрофильного замещения (sе)
- •Ориентирующее действие заместителей в бензольном ядре.
Лекция № 2.
Механизмы реакций.
Химическая реакция – процесс превращения исходных веществ в продукты реакции. Реакция проходит через несколько стадий. Механизм реакции – подробное описание этих стадий.
Классификация реакций:
I тип: по конечному продукту реакции:
-
Замещение – substitution (S)
A –B+C
A–C+B
–B+C
A–C+B
-
П


 рисоединение
– addition
(А)
рисоединение
– addition
(А)


 С=С +А–В
С=С +А–В
-
О
 тщепление
– elimination (Е)
тщепление
– elimination (Е)
![]()
 +
A–B
+
A–B
II тип: по механизму
-
Р
 адикальные
– radical (R) :
идут через радикальный (гомолитический)
разрыв связи
адикальные
– radical (R) :
идут через радикальный (гомолитический)
разрыв связи
R

 3C
X R3C
• + •X
3C
X R3C
• + •X



гомолиз связи радикалы – частицы с неспаренными электронами
-
Ионные реакции, идут через гетеролитический разрыв связи:



 Х
:У
Х+
+ :У–
Х
:У
Х+
+ :У–



гетеролиз связи электрофил (Е+ ) нуклеофил (N–)
«любит электроны» «любит ядро»
Различают:
а) нуклеофильные – nucleophile (N) – реакции, например,
АN – нуклеофильное присоединение
SN – нуклеофильное замещение
б) электрофильные – electrophile (E) – реакции, например,
АЕ – электрофильное присоединение
SE - электрофильное замещение
Механизм реакции радикального замещентия (sr)
In vitro (вне организма) – галогенирование алканов.
Пример: хлорирование метана.
Свет (hν)
С хема
реакции : СН4
+ Сl2
СН3Cl
+ HCl
хема
реакции : СН4
+ Сl2
СН3Cl
+ HCl
хлорметан
Механизм реакции:
I стадия: инициирование, образование свободных радикалов
![]() hν
hν
C l
Cl Cl • + • Cl
l
Cl Cl • + • Cl
гомолиз связи
II. стадия: рост цепи
![]()

 H3C
H + • Cl H3C
• + H :
Cl эти две
реакции повторяются,
H3C
H + • Cl H3C
• + H :
Cl эти две
реакции повторяются,
м![]()
 олекула
радикал радикал молекула пока
есть исходные вещества
олекула
радикал радикал молекула пока
есть исходные вещества
H 3C
• + Cl Cl H3C
:
Cl + Cl •
3C
• + Cl Cl H3C
:
Cl + Cl •
радикал молекула молекула радикал
атакует следующую молекулу метана
III. обрыв цепи – встреча двух свободных радикалов:
C l
• + • Cl Cl :
Cl
l
• + • Cl Cl :
Cl
H 3C
• + • Cl H3C
:
Cl
3C
• + • Cl H3C
:
Cl
H 3C
• + • CH3
H3C
:
CH3
3C
• + • CH3
H3C
:
CH3
Sr in vivo (в организме) пероксидное окисление липидов (пол). Липиды – компоненты клеточных мембран. В результате пол: изменения в обмене веществ, образование канцерогенных соединений. Механизм пол:
-
первоначальное образование R •
F

 e2+
+ O2
+ H Fe3+
+ HO
– O •
X• свободные
радикалы
e2+
+ O2
+ H Fe3+
+ HO
– O •
X• свободные
радикалы
F e2+
+R–O–OH Fe3+
+ HO–
+ RO •
e2+
+R–O–OH Fe3+
+ HO–
+ RO •
-
инициирование
 R
:
H + X • HX + R •
R
:
H + X • HX + R •
липид
-
рост цепи



R
![]() • + O2
R–O–O •
• + O2
R–O–O •
R –O–O
+ R H R–O–O–H + R
•
–O–O
+ R H R–O–O–H + R
•
-
обрыв цепи
R OO
• + • R R–O–OR
OO
• + • R R–O–OR
Механизм реакции электрофильного присоединения (ае)
In vitro: присоединение к алкенам Hal2, HHal, H2O.
Б![]() ромирование
этилена
ромирование
этилена
Пример 1. СН2=СН2 +Br2 →
1,2–дибромэтан
Механизм реакции
I стадия. Поляризация молекулы галогена по действием π-связи алкена
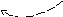 σ δ+ δ–
σ δ+ δ–
Н2С = СН2 Br → Br
π
и образование электрофила Е+
 δ+ δ–
δ+ δ–
Br → Br → Br+ + Br –
гетеролиз Е+
II стадия. Образование π-комплекса за счет вакантной орбитали электрофила и пары электронов в π-связи
С![]() Н2
СН2
Н2
СН2
Br+
I II
стадия.
Образование σ–комплекса (карбкатиона)
II
стадия.
Образование σ–комплекса (карбкатиона)
IV стадия. Присоединение Br – к карбкатиону, образование продукта реакции
![]()
![]()
![]() СН2
–
СН2+
+
Br –
→ CH2
– CH2
СН2
–
СН2+
+
Br –
→ CH2
– CH2
Присоединение HНal или H2O к несимметричным алкенам (R – CH=CH2)
идет по правилу Марковникова В.В.: Н присоединяется к наиболее, а Hal (или ОН–) к наименее гидрогенизированному атому С.
![]() R–CH=CH2
+ HHal → R–CH–CH3
R–CH=CH2
+ HHal → R–CH–CH3
![]() R–CH=CH2
+ H–ОН → R–CH–CH3
R–CH=CH2
+ H–ОН → R–CH–CH3
Пример 2. Присоединение бромоводорода к пропену
С хема
реакции:
хема
реакции:


 δ+ δ–
δ+ δ–
С![]()
 Н3
→
СН=СН + Н+
→
Br –
→
СН3–СН–СН3
Н3
→
СН=СН + Н+
→
Br –
→
СН3–СН–СН3
2–бромпропан
С![]() Н3:
+I,
ЭД,
СН3–СН2–СН2
Н3:
+I,
ЭД,
СН3–СН2–СН2
↑ē плотность,
АЕ к пропену идет легче, чем с СН2=СН2
Механизм реакции (АЕ):
I стадия: Гетеролиз связи в реагенте, образование электрофила (Е+).
H → Br → H+
+ Br –
→ Br → H+
+ Br –
E+
II стадия: Образование π-комплекса за счет вакантной орбитали электрофила и пары электрона π-связи.
 δ+
δ–
δ+
δ–
C![]() H3
→ CH CH2
H3
→ CH CH2
III стадия: Образование σ–комплекса (карбкатиона), причем новая σ–связь образуется между Е+ и атомом С с δ–.
С![]() Н3
– СН+
– СН2
Н3
– СН+
– СН2
IV стадия: Присоединение Br – к карбкатиону, образование продукта реакции
С![]() Н3
– СН+
– СН3
+ Br
–
→
CH3
– CH – CH3
Н3
– СН+
– СН3
+ Br
–
→
CH3
– CH – CH3
![]()
![]() Присоединение
Н2О
(гидратация) к алкенам идет с участием
кислого катализатора (Н+
кислоты играет роль Е+).
Присоединение
Н2О
(гидратация) к алкенам идет с участием
кислого катализатора (Н+
кислоты играет роль Е+).
С![]()
 Н3–СН=СН2
+ Н+
→
СН3–СН
СН2
→
СН3
– СН+
– СН2
+ →
Н3–СН=СН2
+ Н+
→
СН3–СН
СН2
→
СН3
– СН+
– СН2
+ →
катализатор
Е+ π-комплекс σ–комплекс вода
С![]()
![]() Н3
– СН – СН3
→
СН3
– СН – СН3
Н3
– СН – СН3
→
СН3
– СН – СН3
 –Н+-
регенерация
–Н+-
регенерация
катализатора
ион оксония пропанол–2, конечный продукт реакции
АЕ in vivo: гидратация непредельных соединений, идет с участием биокатализаторов (ферментов).


 фермент
фермент
Н![]()


 ООС
– СН = СН – СООН + Н – ОН →
НООС – СН2
– СН – СООН
ООС
– СН = СН – СООН + Н – ОН →
НООС – СН2
– СН – СООН
фумаровая кислота яблочная кислота
