
- •Цнс гипоталамус гипофиз периферические железы ткани мишени
- •1. Гипергликемия вызвана:
- •1.Регуляция процессов биосинтеза белка на генетическом уровне (теория Жакоба и Моно). Гормональная регуляция белкового обмена. Гормоны анаболического и катаболического действия.
- •I . Подготовительная фаза.
- •II фаза. Превращение мономеров в простые соединения - центральные метаболиты (пвк, ацетилКоА)
- •III фаза. Цикл Кребса
- •Соматотропный гормон
- •Тиреотропный гормон
- •II этап - окислительное декарбоксилирование пвк
- •3. Конденсация йодтирозинов
- •II. Биохимия нервной ткани, ее химический состав, особенности обмена.
- •1. Классификация простых белков, их характеристика (альбумины, глобу лины, гистоны, протамины, протеиноиды). Физико-химические свойства простых белков.
- •2. Свободнорадикальное окисление. Понятие о перекисном окислении липи дов.
- •1. Аминокислоты - структурные единицы белка. Классификация аминокислот по структуре радикала. Заменимые и незаменимые аминокислоты. Значение для организма незаменимых аминокислот.
- •1. Биосинтез белка. Активация аминокислот, трансляция. Ингибиторы синтеза белка. Влияние облучения на синтез белка.
- •1.Инициация.
- •2. Элонгация
- •3. Терминация
- •2. Гормоны стероидной природы: глюкокортикоиды, половые гормоны, мине ралокортикоиды. Химическая структура гормонов, механизм действия, влияние на об мен веществ.
- •1. Глюкокортикоиды.
- •2. Тироксин, его синтез, влияние на обмен веществ. Гипотиреоз и гипертиреоз.
1.Регуляция процессов биосинтеза белка на генетическом уровне (теория Жакоба и Моно). Гормональная регуляция белкового обмена. Гормоны анаболического и катаболического действия.
Клетки многоклеточного организма содержат одинаковый набор ДНК, но белки синтезируются разные. Например, соединительная ткань активно синтезирует коллаген, а в мышечных клетках такого белка нет. В эритроцитах содержится Нb, и информация о Нb содержится во всех клетках. С возрастом скорость синтеза изменяется.
Прокариоты.
Теория регуляции биосинтеза у прокариот была разработана в 1961 г. Ф. Жакобом и Ж. Моно. Основные положения теории:
1. неоднородность генетического материала. В геноме имеются:
- структурные гены, которые кодируют синтез структурных белков или ферментов;
- регуляторные гены. Обеспечивают регуляцию считывания информации со структурных генов.
2. регуляция биосинтеза происходит на этапе транскрипции;
3. регуляция осуществляется путем репрессии (подавление транскрипции) и индукции (разрешение транскрипции).
Пр.: работа лактозного оперона.
В клетках микробов имеется фермент лактаза, участвующий в расщеплении лактозы до галактозы и глюкозы. Этот фермент в их клетках вырабатывается только при наличии субстрата – лактозы. Регуляция осуществляется с помощью лактозного оперона. Так, если в среде нет лактозы, то ген-I кодирует синтез белка-репрессора. Белок-репрессор взаимодействует с оператором и в результате РНК-полимераза не может осуществлять транскрипцию. Этот тип регуляции называется репрессией.
Если в среде присутствует лактоза, то она препятствует взаимодействию белка-репрессора с операторм, РНК-полимераза считывает информацию и образуется мРНК лактазы. Т.о. лактоза является индуктором, т.е. веществом, препятствующим взаимодействию белка-репрессора с оператором, в результате чего усиливается и облегчается транскрипция гена лактазы.
У прокариот первичные транскрипты генов (мРНК) используются в синтезе белка еще до завершения процесса транскрипции. У них нет ядерной мембраны.
Эукариоты.
Основные уровни регуляции биосинтеза:
1. на уровне транскрипции. Варианты:
- групповая репрессия генов белками – гистонами;
- амплификация генов - увеличение числа копий заданного участка ДНК или гена. Достигается в результате многократного синтеза ДНК в одном и том же репликативном пузыре. В этом случае транскрипция будет возможна сразу с нескольких копий гена, что увеличивается скорость транскрипции. Эта регуляция изучается у опухолевых клеток, которые способны к амлификации;
- регуляция сигналами-усилителями. Сигналы-усилители - энхансеры - выступающий участок ДНК, который может быть значительно удален от промотора. Под действием энхансера наблюдается более чем 200-кратное увеличение скорости транскрипции. Действует неспецифично, усиливая транскрипцию многих генов.
Пр.: действие гормонов коры надпочечников: глюкокортикоиды проникают внутрь клетки, где взаимодействуют с рецептором, посредством чего проникают в ядро, где присоединяются к ДНК и превращают участок ДНК в энхансер. При этом запускается синтез ферментов, характерных для действия глюкокортикоидов. Данный механизм работает только у эукариот.
2. регуляция на уровне процессинга иРНК:
- разрешение или запрещение процессинга. Так, не все пре-иРНК превращаются в зрелые иРНК: пре-иРНК иРНК;
- дифференциальный (альтернативный) процессинг. В клетках эукариот возможен многовариантный процессинг, поэтому утверждение 1 ген1 белок для них не всегда справедливо. Это происходит в результате потери некоторых экзонов.
Пр.: С-клетки щитовидной железы и нейроны имеют одинаковый ген, который в С-клетках кодирует выработку кальцитонина (регулирует уровень Са2+), а в нейронах дифференцирует процессинг белка CGRP-пептид (регулирует АД).
3. на уровне стабильности и активности иРНК. Чем больше иРНК находится в стабильном состоянии в цитоплазме, тем большее количество молекул белка на ней может быть синтезировано. Поэтому в цитоплазме иРНК консервируются путем взаимодействия с белками-информатионами, образуя комплексы - информосомы.
4. регуляция на уровне трансляции:
- тотальная репрессия или активация трансляции при изменении активности и количества белковых факторов (ФИ и ФЭ);
- избирательная дискриминация иРНК, например, при инфицировании клетки вирусом транслируется вирусная РНК, а РНК хозяина дискриминируется.
- механизм повышения эффективности трансляции включает образование полисом - это комплекс нескольких рибосом с одной иРНК. Расстояние между соседними рибосомами составляет 80 нуклеотидов.
2.Витамин В6, биотин, их химическая структура и признаки витаминной недостаточности. Участие в обмене веществ.
Химическая формула:
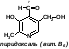
Действие:
Являясь структурной единицей ряда ферментов, витамин В6 играет активную роль в обмене веществ. Он участвует в процессах углеводного, липидного и белкового обмена. Благодаря пиридоксину нормализуется липидный обмен при атеросклерозе. Витамин необходим для нормальной работы центральной и периферической нервной системы. Пиридоксин участвует в обмене целого ряда важных аминокислот и биологически активных веществ. Также витамин В6 обладает регенеративными свойствами. Важной особенностью пиридоксина является то, что он служит антидотом при передозировке некоторых лекарств, таких как противотуберкулезные препараты
Симптомы гиповитаминоза :
начальными проявлениями гиповитаминоза В6 являются поражения кожи в виде дерматитов, которые могут осложняться нагноительными процессами и омертвением участков ткани. Со стороны слизистых оболочек наиболее часты атрофические изменения и воспалительные процессы в виде стоматитов, гастритов и энтероколитов. Довольно часто, особенно в детском возрасте, при авитаминозе В6 поражается нервная система и проявляется это в повышенной раздражительности, сонливости у детей, а при тяжелом авитаминозе могут наблюдаться судорожные припадки, отставание в развитии, задержка в росте. В более старшем возрасте часто возникает повышенная утомляемость, бессонница и снижение работоспособности.
Симптомы гипервитаминоза:
В клинической практике гипервитаминоз В6 не описывается из-за низкой токсичности и высоких темпов метаболизма пиридоксина.
3.Будет ли протекать глюконеогенез, если в клетке цитратный цикл и дыхательная цепь полностью ингибированы. Ответ поясните.
Глюконеогенез – синтез глюкозы из неуглеводных продуктов. Такими продуктами или метаболитами являются в первую очередь молочная и пи-ровиноградная кислоты, так называемые гликогенные аминокислоты, гли-церол и ряд других соединений. Иными словами, предшественниками глюкозы в глюконеогенезе может быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла трикарбоновых кислот.
Билет 13.
Классификация и характеристика сложных белков (липопротеины, хромопротеины, гликопротеины, нуклеопротеины, фосфопротеины).
Липопротеины: а)в протестетическую группу входят ТАГ, фосфолипиды, стериды,
б)синтезируются в печени или в слизистой оболочке кишечника. Биологическая роль липопротеинов: а)входят в состав плазматических мембран (20-80%), б)содержатся в нервной ткани, в)находятся в плазме крови ХМ, ЛПНП, ЛПВП, ЛПОНП.
Хромопротеины: состоят из простого белка и связанного с ним окрашенного компонента. Например: гемоглобин, миоглобин.
Гликопротеины (гликоконъюгаты): а)белки, содержащие олигосахаридные цепи, ковалентно присоединённые к полипептидной основе, б)углеводные компоненты ковалентно соединены с азотом аспарагина молекулы белка, в)при развитии ряда болезней (рак, астма, иммунодефицит, ревматоидный артрит) изменяются структуры гликоконъюгатов. Функции гликопротеинов: 1)структурная (находятся в плазматических мембранах), 2)смазочная и защитная (муцины, слизь), 3)транспорт витаминов, липидов, микроэлементов (все белки плазмы крови, кроме альбуминов, гликопротеины),
иммунологическая (иммуноглобулины, антигены гистосовместимости, комплемент, интерферон), 4)гормоны (хорионический гонадотропин, ТТГ), 5)ферменты (протеазы, нуклеазы, гликозидазы, гидролазы, факторы свёртывания), 6)места клеточных контактов распознавания, 7)гормональные рецепторы, 8)лектины влияют на эмбриональное развитие и дифференцировку, могут влиять на выбор мест метастазирования раковых клеток.
Нуклеопротеины - состоят из белка и нуклеиновой кислоты: белок – гистоны, протамины,
НК – ДНК, РНК – полинуклеотиды, состоящие из мононуклеотидов. Значение нуклеотидов: а)синтез НК, б)энергетическая роль, в)коферменты, г)транспортная функция.
Фосфопотеины: состоят из белка и фосфорной кислоты, фосфорная кислота присоединяется через ОН-группу серина. Пример фосфопротеинов: казеиноген в молоке, овальбумин и фосвитин в яйцах, ихтулин в икре рыбы, в большом количестве содержатся в клетках ЦНС. Биологическая роль фосфопротеинов: входят в состав мозга, в растущем организме фосфор – пластический материал, способны отдавать фосфорную кислоту для макроэргов и ферментов.
2.
Вторичный липолиз триглицеридов.
Окисление глицерина до конеч¬ных
продуктов (СО2 и Н2О). Биоэнергетика
процесса.
![]()

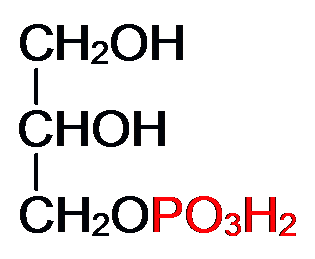

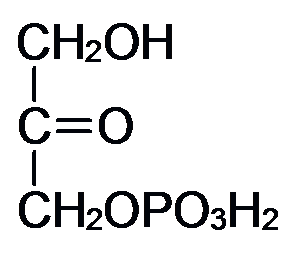

Окисление глицерина:
Баланс аэробного распада глицерина: От глицерина до ФГА затрата – 1 АТФ и получение + 3 АТФ (окислительное фосфорилирование). На втором этапе гликолиза при окислении 1 молекулы ФГА получаем 2 АТФ и 1 НАДН+Н, то есть 2+3=5 АТФ. Таким образом от глицерина до ПВК получаем (3-1) + 5 = 7АТФ. Окислительное декарбоксилирование ПВК даёт 3АТФ. ЦТК даёт 12 АТФ. ИТОГО: 7+3+12 = 22АТФ даёт окисление 1 молекулы глицерина в аэробных условиях.
3Больной 40 лет поступил в клинику с жалобами на боли в правом под¬реберье, желтушность кожи. Какие биохимические показатели (пигменты крови и мочи, активность ферментов) помогут уточнить вид желтухи?
Билет 13 АСТ/АЛТ
уробилин-моча
билирубин и уробилиноген-кровь
Билет 14
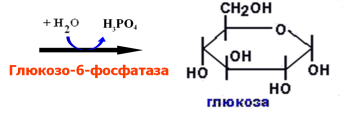
Структура гликогена, синтез и распад гликогена в печени и мышцах. Гликогенозы.
Гликоген
В организме человека содержится до 450
г гликогена. 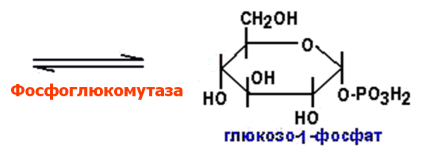
Синтез
гликогена:

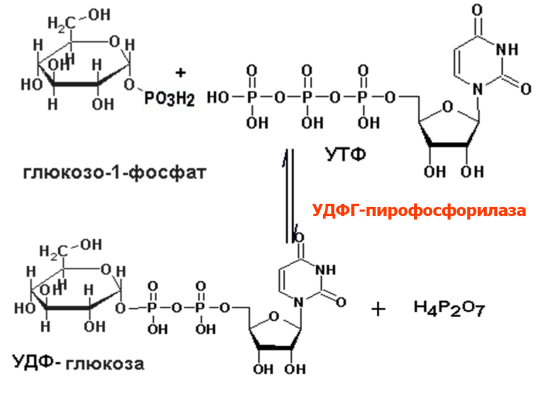
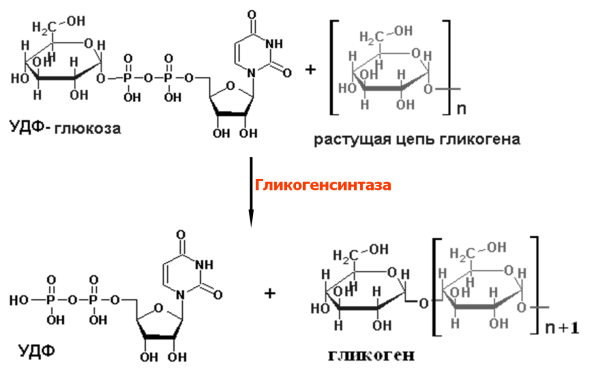



Распад
гликогена: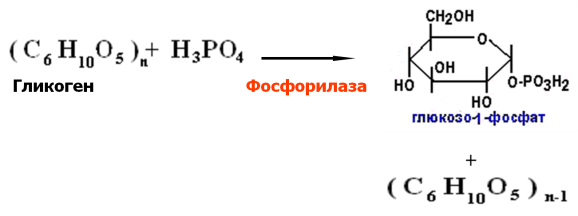
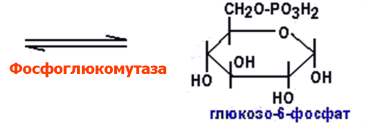
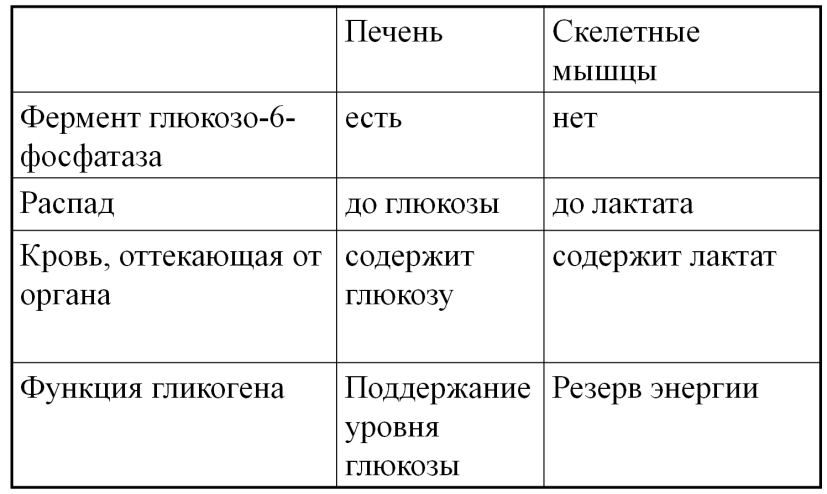
Функциональные отличия гликогена печени и мышц:
Изогидрия. Механизмы поддержания изогидрии. Ацидоз и алкалоз.
Изогидрия – постоянство рН, обусловленное действием буферных систем и физиологическим контролем.
В норме кислотно-основной баланс поддерживается тремя механизмами:
Буферные системы
Респираторный контроль CO2
Почечная компенсация
Буферные системы организма устраняют сдвиги рН:
бикарбонатная,
фосфатная,
белковая,
гемоглобиновая.
Физиологические механизмы восстанавливают и буферную ёмкость.
Ацидоз – избыточное содержание анионов кислот.
Компенсированный ацидоз – закисление без сдвига рН.
Некомпенсированный ацидоз – сдвиг рН в кислую сторону (при рН<6,8-смерть).
Различают:
дыхательный (газовый) ацидоз,
метаболический (обменный) ацидоз.
Газовый ацидоз –увеличение концентрации углекислоты и повышение парциального давления углекислого газа в крови, гиперкапния.
Развивается при уменьшении легочной
вентиляции, при вдыхании воздуха
с высокой концентрацией углекислого газа:
пребывание в непроветренном помещении,
при воспалительных процессах в лёгких,
при неправильном проведении искусственного дыхания.
Метаболический ацидоз – избыточное накопление кислот в организме.
Кетоацидоз – неполное окисление жиров и избыточное накопление ацетоновых тел при диабете, голодании.
Лактоацидоз – при усиленной физической работе, гипоксиях, кардиогенном шоке, тяжёлых поражениях печени, длительных лихорадочных состояниях, инфекциях.
Азотемический ацидоз – в крови и тканях в избытке накапливаются фосфаты, сульфаты, анионы органических кислот (при уремии).
При избыточном экзогенном введении органических кислот в организм (при отравлении уксусной кислотой, бесконтрольном приёме салицилатов, соляной кислоты).
Кишечный ацидоз - избыточная потеря HCO3- через почки или ЖКТ.
Диабетический кетоацидоз:
Анализ крови при кетоацидозе
pH = 7.15
Глюкоза = 22 ммоль/л,
cHCO3- = 10 ммоль/л,
cK+ = 2.5 ммоль/л.
Проведена терапия:
инсулин
Жидкость и калий, восполнение потерь
Бикарбонат, нормализация pH
Уровень глюкозы в крови определяется каждые 1-2 часа в комбинации с pH, электролитами и газами крови.
При метаболическом ацидозе:
снижаются стандартные бикарбонаты плазмы (щелочной резерв крови), так как кислоты вытесняют из гидрокарбонатов угольную кислоту,
увеличивается кислотность мочи и концентрация аммиака в моче.
У доношенного новорожденного несколько дней наблюдается физиологический ацидоз:
Это смешанная форма:
компонент газового ацидоза – гиперкапния,
компонент метаболического – увеличение концентрации лактата.
Некомпенсированный ацидоз – это ацидоз,
связанный с:
развитием гипоксии у плода,
незрелостью дыхательного центра, почек у плода.
Алкалоз- нарушение КЩР, при котором в крови увеличена концентрация катионов и снижена концентрация Н.
Компенсированный алкалоз – рН в крови в норме.
Некомпенсированный алкалоз – рН >7,45.
Различают:
газовый алкалоз,
метаболический алкалоз.
Газовый алкалоз:
вызывается повышенным выделением углекислого газа с выдыхаемым воздухом (гипервентиляционный), следствием чего является снижение парциального давления углекислоты,
сочетается со снижением концентрации кальция в крови, в результате чего возникает тетания,
снижение концентрации калия приводит к нарушениям сердечного ритма.
Причины газового алкалоза:
Стимуляция дыхательного центра
при энцефалитах, истерии, опухолях, сильном плаче у детей,
при отравлениях салицилатами,
под влиянием лекарств – возбудителей дыхательного центра (теофиллин, лобелин),
Рефлекторная стимуляция дыхательного центра при
горной болезни,
заболеваниях лёгких,
инфекционных токсикозах у детей (гипервентиляционный синдром
Метаболический алкалоз – в крови накапливаются основания, дефицит ионов водорода.
Причины:
чрезмерные потери желудочного сока, сопровождающиеся рвотой (гастритический алкалоз при пилоростенозе),
повышенное выделение ионов водорода, обусловленное гипокалиемией (при приёме диуретиков),
избыточное введение в организм солей щелочных металлов (при питье минеральных вод).
При метаболическом алкалозе:
увеличена концентрация HCO3-,
увеличен ВЕ,
снижена кислотность мочи,
уменьшается содержание аммиака в моче.
У детей метаболический алкалоз наблюдается при:
пилоростенозе,
спазмофилии,
хлордиарее (врождённое заболевание).
3. Сипмтомами авитаминоза В1 является расстройство нервной систе¬мы, потеря памяти, изменение психики. Почему к дефициту витамина В1 особо чув¬ствительна центральная нервная система?
Билет 15.
Паратгормон и тиреокальцитонин. Влияние гормонов на обмен кальция и фосфора в организме человека
Паратгормон
- пептид из 84 аминокислот.
Выделяется при уменьшении содержания
кальция в крови.
Органы-мишени: почки, костная ткань
способствует резорбции кости остеокластами и вымыванию солей кальция в кровь
снижает экскрецию кальция и повышает экскрецию фосфора почками
посредством стимуляции синтеза кальцитриола в почках увеличивает эффективность всасывания кальция в кишечнике.
В крови при действии паратгормона возрастает концентрация кальция.
Тиреокальцитонин
- пептид из 32 аминокислот
Секретируется клетками щитовидной железы.
Мишень кальцитонина – костная ткань
Кальцитонин способствует:
отложению кальция и фосфора в кости
в результате деятельности остеобластов,
подавлению резорбции кости
(ингибитор остеокластов).
При действии кальцитонина концентрация кальция в крови уменьшается и возрастает в костях.
Сопряжение обмена углеводов и липидов. Сопряжение обмена углеводов и аминокислот. Пути превращения и образования пировиноградной кислоты.
Взаимосвязь обменов осуществляется благодаря интегрирующим системам:
нервной,
эндокринной,
сосудистой.
Взаимосвязь обеспечивается различными уровнями:
информационный уровень,
структурный уровень,
общее энергетическое обеспечение,
на уровне общих метаболитов,
на уровне Ц.Т.К.
Взаимосвязь углеводного и липидного обменов осуществляется через:
ацетил-КоА,
ФГА,
НАДФН2 из пентозного цикла идёт на синтез жирных кислот,
ЩУК нужен для работы Ц.Т.К.
Жиры сгорают в пламени углеводов.
При избытке в пище углеводов возникает ожирение.
ФГА и ацетил-КоА– источники глицерина и жирных кислот.
При спячке у животных происходит образование
углеводов из жиров.
Взаимосвязь белкового и жирового обменов на уровне:
ПВК,
ацетил-КоА,
кетоновых тел.
Из белков осуществляется синтез жира.
Взаимосвязь углеводного и белкового обменов на уровне:
ПВК,
ЩУК,
ацетил-КоА,
пентоз,
глюкопластичных и кетопластичных аминокислот.
Углеродные скелеты АМК вступают в Ц.Т.К.
Возможно образование углеводов из белков (ГНГ)
и белков из углеводов (из ПВК образуется аланин).
Сопряжение на уровне Ц.Т.К
углеродные скелеты АМК включаются в Ц.Т.К,
все кислоты Ц.Т.К. превращаются в ЩУК (ГНГ),
взаимосвязь Ц.Т.К. с синтезом мочевины через фумарат, асп, СО2,
СО2:
ЩУК,
жирные кислоты
азотистые основания
мочевина
Ц.Т.К обеспечивает энергией все обмены.
При тяжелых вирусных гепатитах у больного может развиться печеночная кома, обусловленная токсическим действием аммиака на клетки мозга. Какова причина накопления аммиака в крови? Как изменится концентрация мочевины в крови у данных больных?
Билет 15 азотемия. Понижен функц почек воз-ие повыш мочевины и креатина. Токсич возд вещ-в
Билет 16
1)обмен и биологическое значение серосодержащих аминокислот (метионин и цистеин). Участие метионина в реакциях трансметилирования. Молекулярная патология обмена этих аминокислот.
Обмен метионина
Метионин
незаменимая АМК,
гликогенная АМК.
Пищевые источники: яйца,молочные продукты,мясо
Судьба метионина. Метионин: -холин
-Мелатонин
-Адреналин
-Креатин
-кавритин
-Тимин
Метионин участвует в реакциях трансметилирования:
Трансметилирование – перенос метильной группы.
Донором метильной группы служит S-аденозилметионин.
Метильная группа стаёт подвижной с помощью АТФ.
Кофермент, переносящий метильную группу – ТГФК.
Реакции трансметилирования применяются в:
синтезе фосфатидилхолина,
синтезе карнитина,
синтезе креатина,
синтезе адреналина из норадреналина,
синтезе анзерина из карнозина,
метилировании азотистых оснований в нуклеотидах,
инактивации метаболитов и обезвреживании чужеродных соединений.
Гомоцистеин расходуется на
синтез цистеина,
регенерацию метионина.
При избытке гомоцистеина возникают тромбозы.
Наряду с ТГФК метилкобаламин – промежуточный переносчик метильной группы.
Вторая активная форма метионина – витамин U
предупреждает развитие язвы,
используется против атеросклероза, жировой инфильтрации печени,
притупляет боль,
тормозит выделение гистамина.
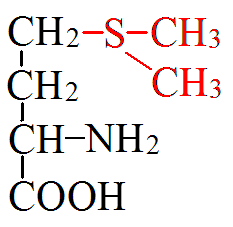
Цистеин:
глюкопластичная,
условнозаменимая.
Пищев.источники: свин,курин. Филе
Судьба цистеина. Цис:
-КоАSH
-Инсулин,вазопрессин,окситоцин
-таурин
-Активный центр ферментов
-Цистин
-Глутатион
Блоки
Гомоцистеинурия
возникает при отсутствии цистотионазы,
лечение ФП,
в клетках нервной ткани откладывается гомоцистеин, что ведёт к умственной отсталости,
остеопороз, смещение хрусталика, страдает костный мозг,
тромбоэмболия в почках, с мочой выделяется метионин и гомоцистеин.
Гомоцистеин препятствует образованию нормальных поперечных сшивок в коллагене, повреждает интиму сосудов.
Цистинурия (ЦОАЛ)
возникает при аномальной реабсорбции АМК в канальцах почек,
с мочой увеличивается экскреция цистеина, орнитина, аргинина, лизина из-занарушения обратного всасывания,
цистин слабо растворим, возникают цистиновые камни в почечных канальцах.
Цистиноз (болезнь накопления)
наследственное заболевание,
причина болезни – нарушение функции лизосом,
в основе болезни – дефект окисления цистина в тканях, дефект реабсорбции АМК в почечных канальцах,
кристаллы цистина откладываются во многих тканях и органах,
нарушена функция почечных канальцев.
Цистотионинурия
возникает, если нет цистотионазы,
умственная отсталость,
камни в почках,
психические расстройства.
2. Микроэлементы: селен, цинк, марганец, стронций, фтор, йод, молибден. Микроэлементозы.
Микроэлементозы – патологические процессы, вызванные дефицитом, избытком или дисбалансом микроэлементов в организме
Различают микроэлементозы:
природные,
техногенные,
Ятрогенные
Природные микроэлементозы
не связаны с деятельностью человека,
могут быть экзогенными и эндогенными,
приурочены к определённым географическим областям,
к ним относятся эндемические заболевания (флюороз, недостаточность йода).
Техногенные микроэлементозы связаны с производственной деятельностью человека.
Различают:
промышленные микроэлементозы – развиваются в зоне производства
соседские микроэлементозы – развиваются вблизи заводов, промышленных предприятий,
трансгрессивные микроэлементозы – развиваются в отдалении от производства за счёт водного или воздушного переноса микроэлементов.
Ятрогенные микроэлементозы
связаны с интенсивным лечением, диализом. Диализ не обеспечивает организм необходимым уровнем жизненно важных микроэлементов.
Вторичные микроэлементозы возникают
как следствие хирургических операций на ЖКТ с повреждением основных зон всасывания микроэлементов,
при гельминтозах (описторхоз, дифиллоботриоз).
ЦИНК
В организме взрослого человека 1,5-2 г цинка:
из них 98% содержится внутри клеток,
2% в сыворотке.
В плазме крови содержится 17,1 мкмоль/л цинка.
Много цинка в
ткани глаза,
слезе,
слюне,
печени,
костной ткани,
простате,
железах внутренней секреции
Пищевые источники :
яйца,
мясо,
молоко,
печень,
морские продукты,
грибы,
укроп,
чеснок,
зерно.
Суточная потребность 15 мг цинка.
Всасывание цинка в тонком кишечнике Усиливают:
высокий уровень белка в рационе,
лизин, цистеин, глицин, глутаминовая кислота,
низкий уровень железа в рационе,
простагландин Е2.
Уменьшают:
фитин,
медь,
высокий уровень железа в рационе,
клетчатка
высокий уровень кальция в рационе,
низкое содержание белка.
Выводится цинк:
на 90% с калом,
на 10% с мочой, потом, желчью.
В сыворотке крови цинк связан с
альбумином,
α2- макроглобулином,
трансферрином,
цистеином,
гистидином.
Биологическая роль:
более 200 ферментов имеют в своем составе цинк (СОД, карбоангидраза, ЛДГ, МДГ, аминопептидазы,
фосфолипаза С, ДНК-полимераза, альдолаза, пируваткарбоксилаза),
участввует в синтезе белка и нуклеиновых кислот (в кодазах, обратных транскриптазах есть цинк, нужен для образования пептидной связи),
антиоксидант (стабилизирует сульфгидрильные группы, клеточные мембраны),
обладает липотропными свойствами,
усиливает заживление ран,
стимулирует синтез гормонов,
участвует в кальцификации
влияет на развитие мозга, вкус, обоняние,
влияет на иммунный ответ, необходим для действия Т-лимфоцитов,
подавляет размножение вирусов,
принимает участие в метаболизме витамина А (синтез ретинол-связывающего белка).
При недостатке цинка:
угнетается образование антител,
снижается число лимфоцитов,
падает масса тимуса,
снижение иммунитета,
дерматит, гиперкератоз кожи,
изменения слизистых и кожи,
диарея,
тяжелые вирусные, грибковые, бактериальные поражения,
нарушение вкуса, обоняния, адаптации в темноте,
нейропсихические нарушения,
остеомаляция,
задержка роста, полового развития.
Падает содержание цинка в плазме при:
стрессе,
инфаркте миокарда,
анемиях,
гломерулонефрите.
Этот процесс регулируется лейкоцитарным
эндогенным медиатором.
Он вырабатывается фагоцитами.
Причины недостатка цинка в организме человека:
недостаточное поступление с пищей,
нарушение всасывания из-за воспалительных заболеваний кишечника,
недостаточность поджелудочной железы,
повышенное выделение при приёме мочегонных препаратов,
нехватка белков (при циррозе печени),
действие алкоголя,
стрессы, инфекции, анемии.
МАРГАНЕЦ
В организме взрослого человека содержится 10–20 мг.
Много марганца в:
сетчатке,
костях,
печени,
почках,
лейкоцитах,
митохондриях клеток.
Пищевые источники: бобы,злаки
Биологическая роль:
входит в состав ферментов (пируваткарбоксилаза, аргиназа, СОД), в качестве кофактора активирует киназы, фосфатазы, трансферазы,
необходим для эритропоэза, ускоряет созревание ретикулоцитов,
нужен для синтеза ГАГ хрящевой ткани,
влияет на центральную нервную систему, (судороги при дефиците марганца),
необходим для нормального роста ребенка,
ускоряет образование антител,
стимулирует синтез холестерина,
необходим для нормальной секреции инсулина,
необходим для костеобразования
Избыточное поступление марганца:
ведет к повышению его концентрации в костях и появлению в них изменений, идентичных изменениям при рахите (марганциевый рахит).
Марганец – это агрессивный нейротропный яд. Ему присущи кумулятивные свойства. Возможны производственные отравления при добыче руды.
Дефицит Mn приводит к нарушению синтеза
гликозаминогликанов хрящевой ткани и задержке
роста.
СЕЛЕН
всасывается через
кожу,
легкие,
пищеварительный тракт.
транспортируется белками:
селенопротеин Р из плазмы,
селенопротеин Р из почек и печени.
выделяется через
почки,
кишечник,
с выдыхаемым воздухом.
В организме человека селен находится в:
эритроцитах,
печени,
почках,
поджелудочной железе
Биологическая роль:
входит в активный центр глутатионпероксидазы, является антиоксидантом,
селен входит в селеноаминокислоты (селенометионин, селеноцистеин),
участвует в окислительно-восстановительных процессах, дыхании клетки,
антиканцерогенный, антимутагенный эффект.
При недостатке селена:
у животных развивается алиментарная мышечная дистрофия,
у людей – эндемическая миокардиопатия,
алиментарная дистрофия поджелудочной железы,
кистозный фиброз поджелудочной железы,
нарушается воспроизводительная функция,
эозинофильный энтерит.
При избытке селена:
развивается селеновый токсикоз:
поражение ногтей,
волос,
шелушение кожи,
желтушность,
поражение эмали зубов,
артриты,
анемия,
расстройства нервной системы.
МОЛИБДЕН
содержится в зелёных растениях,
всасывается в тонком кишечнике,
выделяется с мочой,
молибден и медь – антагонистты.
Биологическая роль:
1. В животных организмах присутствуют 3 молибденсодержащих фермента:
ксантиноксидаза,
альдегидоксидаза,
сульфитоксидаза.
2. Молибден – ростовой фактор бактерий.
Может привести к избыточному размножению
их в кишечнике.
Сульфитоксидаза превращает сульфит в сульфат.
При генетическом дефекте этого фермента:
аномалии мозга,
умственная отсталость,
эктопия хрусталика,
повышенное выделение с мочой сульфатов.
Молибденовая подагра
возникает при повышенном синтезе ксантиноксидазы,
образуется много мочевой кислоты,
почки не справляются с выделением мочевой кислоты.
ЙОД
В организме взрослого человека 20-30 мг йода.
10 мг содержится в щитовидной железе.
Суточная доза -150 мкг йода.
Йод всасывается через кожу, слизистые, лёгкие.
Выделяется через почки,
экскреторными железами
Пищевые источники: морские продукты (рыба, водоросли),
редька,
морковь,
помидоры,
ревень.
горох,
грибы,
клубника,
капуста,
лук,
желток.
Биологическая роль:
нужен для функционирования щитовидной железы,
связан с сопротивляемостью организма,
оказывает седативное влияние на ЦНС,
повышает умственную работоспособность,
один из лучших катализаторов окислений в организме.
Восполнен недостаток йода может быть:
пищей, богатой йодом,
смазыванием йодом,
применением йодистых препаратов: рыбий жир, таблетки из водорослей, раствор Люголя, раствор йода.
ФТОР
на 60% поступает с водой,
содержится в чае.
При недостатке фтора – кариес.
Лечение: вода и паста с фтором.
При избытке – флюороз.
Стронций
близок к кальцию и может
включаться в костную ткань вместо него,
Уровская болезнь –
избыток стронциевого апатита,
ломкость костей.
3. Оценить состояние больного, если: рН крови - 7,31, рН мочи - 4,8. Общее содержание СО2 в крови повышено. рСО2 - 80 мм рт ст. Титрометрическая кислотность мочи повышена.
Билет 17.
Основные пути обмена аминокислот: декарбоксилирование, дезаминирование. Биологическая роль биогенных аминов.
Дезаминирование АМК- отщепление аминогруппы в форме аммиака с образованием безазотистого остатка АМК.
Выделяют четыре типа дезаминирования:
окислительное,
внутримолекулярное,
восстановительное,
гидролитическое.
В организме человека преобладает окислительное дезаминирование
С наибольшей скоростью идёт дезаминирование глу.
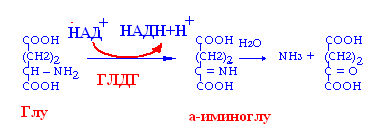
Непрямое дезаминирование:
характерно для остальных АМК,
активно происходит в печени,
идёт в 2 этапа:
трансаминирование АМК с а-кетоглутаровой кислотой с образованием глу,
дезаминирование глу
Неокислительное дезаминирование серина, гистидина и треонина:
идёт за счёт дегидратаз,
гистидин и серин могут дезаминироваться и непрямым путём а треонин только этим.
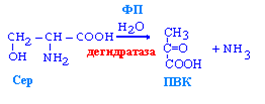
Окислительное дезаминирование (минорный путь):
оксидазы АМК (кофермент ФМН),
оксидазы D-АМК (кофермент ФАД) – автоокисляемые флавопротеины.
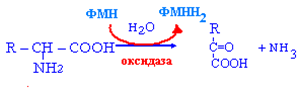
![]()
Декарбоксилирование АМК – процесс отщепления карбоксильной группы АМК в виде углекислого газа.
реакции необратимы,
образуются биогенные амины,
ферменты – лиазы,
кофермент –ФП
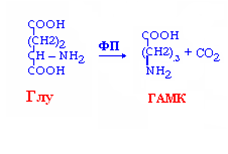
ГАМК:
реакции необратимы,
образуются биогенные амины,
ферменты – лиазы,
кофермент –ФП
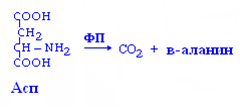
β-аланин входит в состав ансерина и карнозина.
Декарбоксилирование ароматических аминокислот
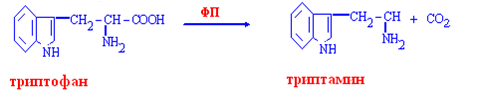
Образование гистамина
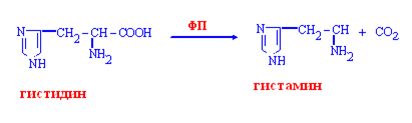
Гистамин:
образуется в тучных клетках,
оказывает сосудорасширяющее действие,
участвует в секреции соляной кислоты в желудке,
медиатор боли, аллергических реакций,
имеет отношение к сенсибилизации,
выделяется при шоке, воспалении.
Образование серотонина
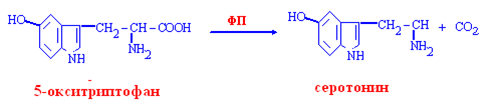
Серотонин:
образуется нейронами
гипоталамуса и ствола мозга,
медиатор нейронов,
химический регулятор эмоций, его содержание в мозге снижается при депрессиях,
повышает свёртываемость крови,
оказывает сосудосуживающее действие,
регулятор АД, температуры, дыхания,
имеет отношение к сенсорному восприятию.
Образование дофамина
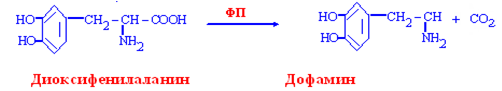
Дофамин:
производное тирозина,
медиатор ингибирующего типа одного крупного проводящего пути (нейроны в чёрной субстанции ствола мозга), при паркинсонизме его содержание снижается,
медиатор нейронов, аксоны которых заканчиваются в лимбических структурах переднего мозга и в зонах, контролирующих высвобождение ряда нейрогормонов. Избыток дофамина в этих областях наблюдается при шизофрении,
предшественник меланина, адреналина, норадреналина.
Таурин образуется из цистеина:
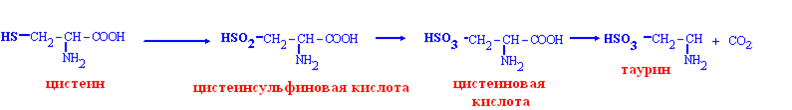
Таурин:
участвует в образовании желчных кислот,
медиатор на уровне синапсов.
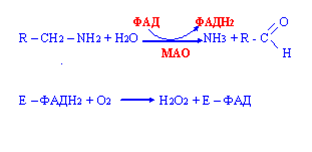
Распад биогенных аминов:
идет в 2 этапа:
первая стадия – анаэробная, образуется аммиак и восстановленный фермент,
вторая стадия – аэробная, восстановленный фермент окисляется молекулярным кислородом.
Накопление биогенных аминов: отрицательно сказывается на физиологическом статусе
2. Витамины Р и С, их структура, признаки витаминной недостаточности, влияние на обмен веществ.
Витамин С (Аскорбиновая кислота) 50-100мг/сут
Функции:
стимулирует работу ЦНС,
улучшает общее самочувствие, настроение,
повышает сопротивляемость организма,
участвует в окислительно-восстановительных реакциях,
нормализует обмен холестерина,
способствует усвоению железа и нормальному кроветворению,
укрепляет кровеносные сосуды, кости, заживляет раны, участвуя в синтезе коллагена,
антиоксидант.
Участвует в гидроксилировании, образовании коллагена, включении железа в ферритин. Повышает устойчивость организма к инфекциям.
Пищевые источники: Свежие фрукты, растения: шиповник, черная смородина, цитрусовые.
Авитоминоз/гипервитаминоз:
Развивается цинга (кровоточивость десен, мелкие кровоизлияния в коже, поражение стенок кровеносных сосудов). Нарушение синтеза коллагена.
Как кофактор аскорбиновая кислота:
участвует совместно с кофактором Fе в созревании коллагена,когда почти половина остатков пролина проколлагена послесинтеза на рибосоме гидроксилируется в гидроксипролин с помощью пролилгидроксилазы, а остаток лизина гидроксилируется аналогично в гидроксилизин с помощью лизилгидроксилазы.
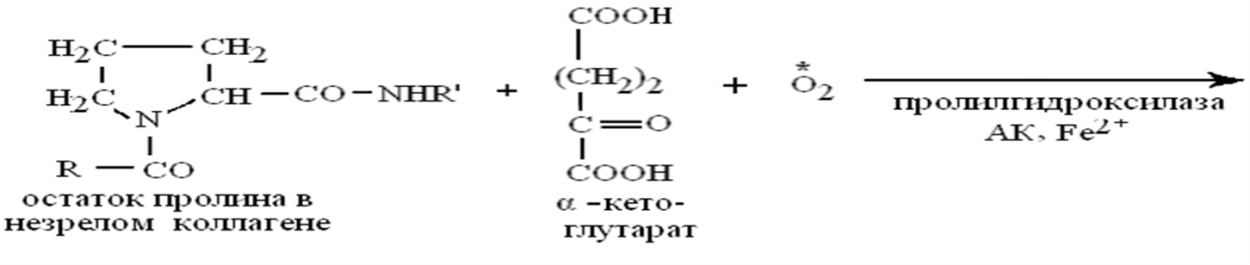
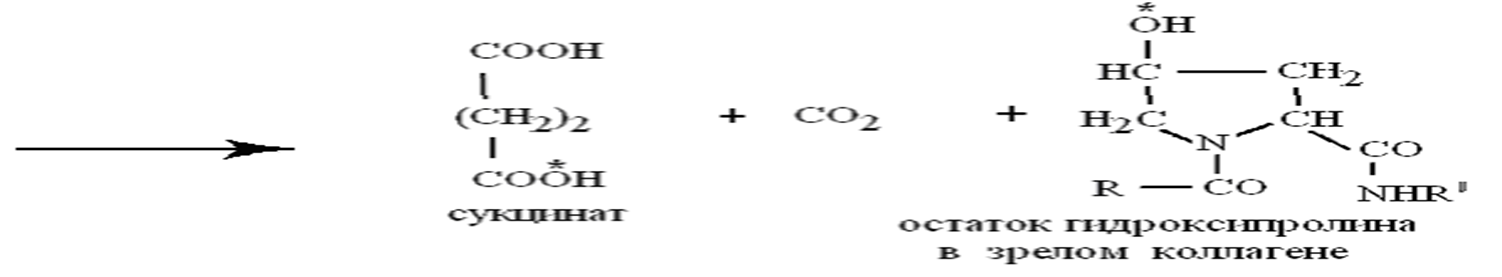
Враги витамина С
За 1 час стресса уничтожается
дневная норма витамина С.
Каждая сигарета «крадёт»
у организма 10 мг витамина С.
Витамин Р-рутин
Функция:
Укрепляет стенки капилляров, регулируя их проницаемость, усиливает действие аскорбиновой кислоты. Стабилизирует основное вещество соединительной ткани путем ингибирования гиалуронидазы.
Пищевые источники:
В листьях руты душистой, гречихи, чайного куста; цитрусовые, черная смородина.
Авитоминоз/гипервитаминоз:
Повышает проницаемость сосудов – кровотечения, общая слабость, боли в конечностях.
3. У больного после переливания крови развилась желтуха. Какой вид желтухи можно заподозрить? Как изменились показатели пигментного обмена в крови и моче?
Билет 17 Гемолитическая. В крови-несвободный билирубин. в моче уробилин повышен
Билет 18.
Классификация ферментов. Общая характеристика класса оксидоредуктаз. Коферменты оксидоредуктазных реакций.
В основе классификации лежит тип катализируемой реакции.
Оксидоредуктазы катализируют окислительно-восстановительные реакции.
Трансферазы - реакции с переносом групп.
Гидролазы - гидролитический разрыв связи СС, СN, СS с присоединением воды по месту разрыва.
Лиазы – реакции негидролитического расщепления с образованием двойных связей, некоторые обратные реакции синтеза.
Изомеразы – перенос групп внутри молекулы с образованием изомеров.
Лигазы катализируют соединение двух молекул, сопряжённое с разрывом пирофосфатной связи АТФ
Оксидоредуктазы:
Окисление идёт путём
дегидрирования,
отщепления электрона,
присоединения атома или молекулы кислорода.
Тип катализируемой реакции: окислительно-восстановительные реакции
Кофермент: НАД,НАФ, ФАД,ФМН
Подкласс: 1.1. СН-ОН
С=О
Коферменты оксидоредуктаз
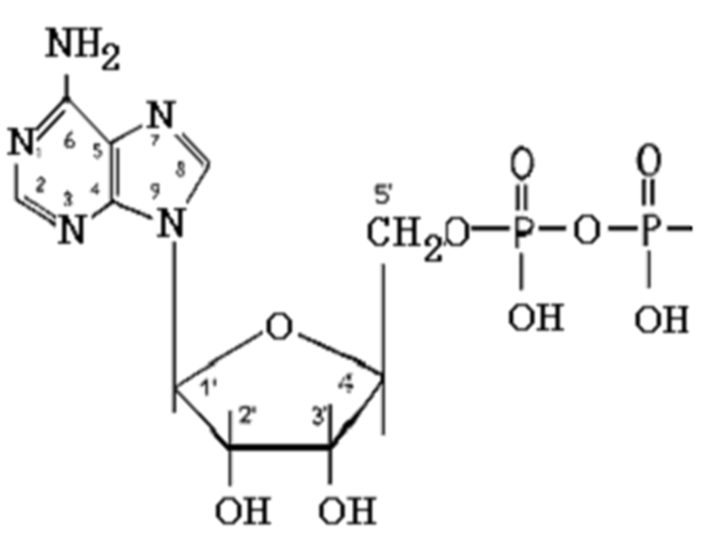
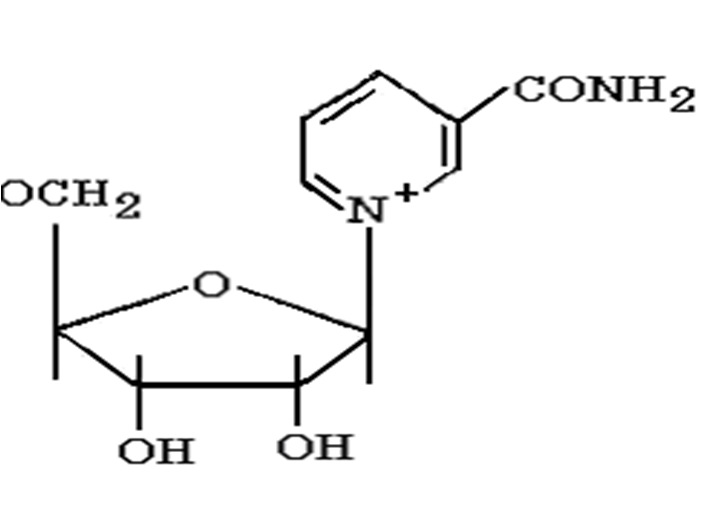
НАД
НАД и НАДФ:
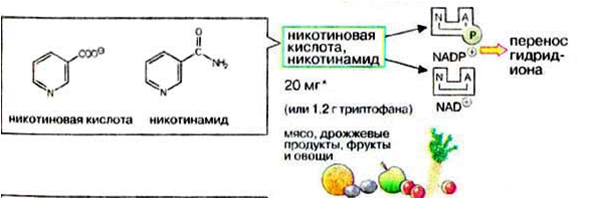
Никотинамидадениндинуклеотид (НАД) и никотин-амидадениндинуклеотидфосфат (НАДФ) - производные витамина РР -никотинамида (антипеллагрического витамина).
Пеллагра - авитаминоз РР:
дерматит,
деменция,
диарея.
Симптомы пеллагры наиболее резко выражены у больных с недостаточным белковым питанием. Это объясняется недостатком триптофана, который является предшественником никотинамида.
Пищевые источники витамина РР:
дрожжи,
продукты животного происхождения,
гречиха,
грибы.
Обратимая окислительно-восстановительная реакция, катализируемая НАД- и НАДФ-зависимыми дегидрогеназами
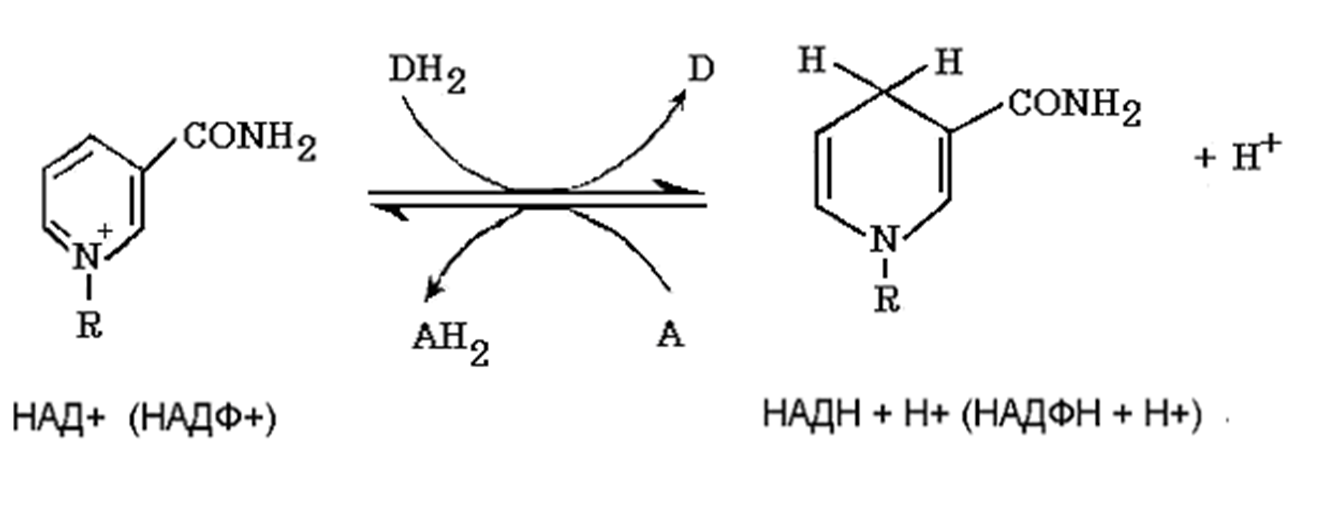
К НАД присоединяются 2 электрона и один протон, второй протон остаётся в растворе для подкисления.
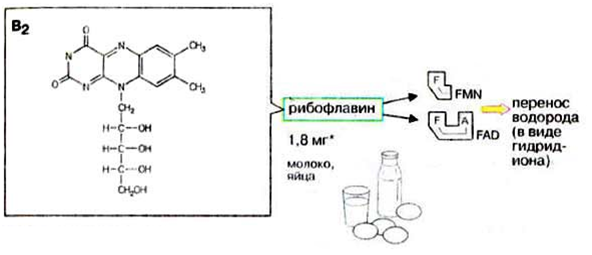
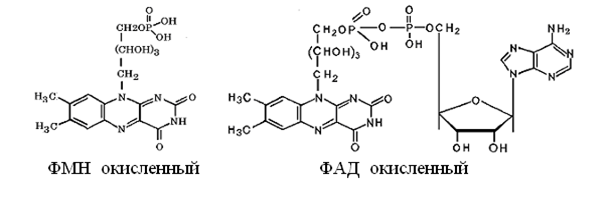
Флавиновые коферменты
Флавинмононуклеотид (ФМН) и
флавинадениндинуклеотид (ФАД) являются производными
витамина В2 (диметилизоаллоксазинрибитола).
ФАД представляет собой соединение ФМН с АМФ
Обратимая окислительно-восстановительная реакция, катализируемая ФМН- и ФАД-зависимыми дегидрогеназами
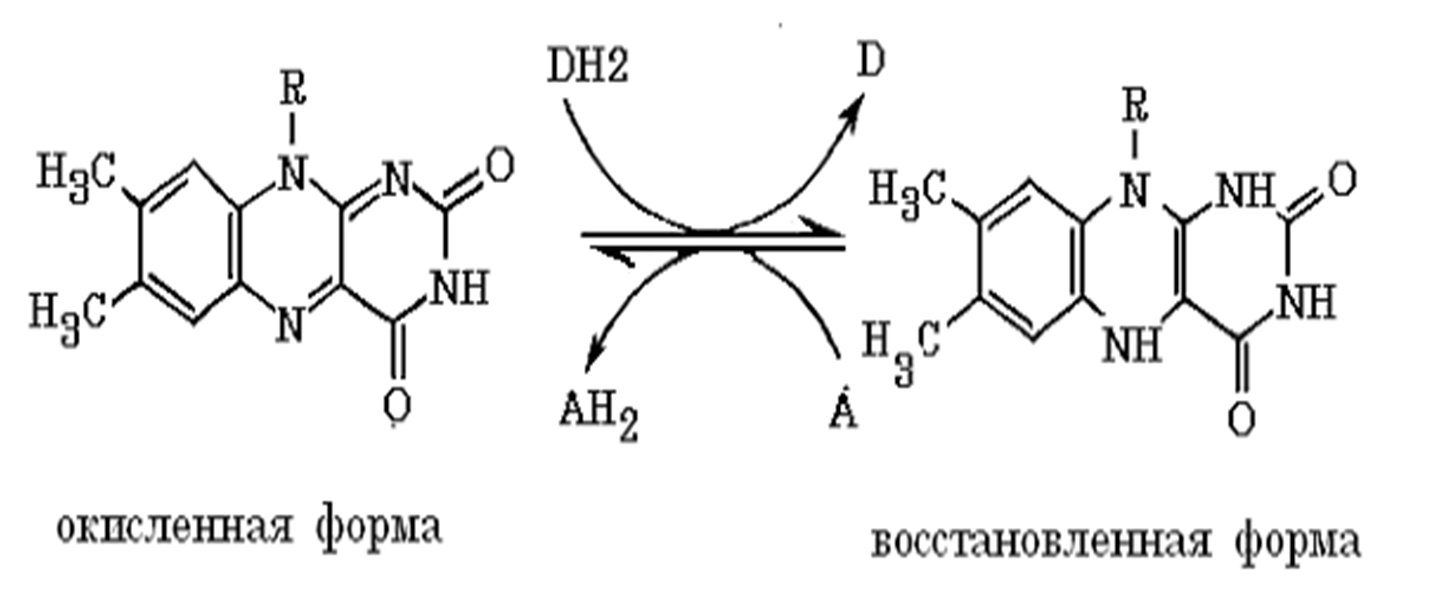
Дефицит витамина В2
расстройство пищеварения и нервной системы,
хронические гастриты и колиты,
общая слабость,
кожные заболевания,
снижает сопротивляемость болезням.
Пищевые источники витамина В2
капуста,
горох,
яблоки,
зеленая фасоль,
помидоры,
репа,
дрожжи,
яйца,
печень,
мясо,
молоко.
Коэнзим Q (убихинон)
представляет собой 2,3-диметоксихинон-5-метил, замещенный в 6-м положении полиизопреновой цепью.
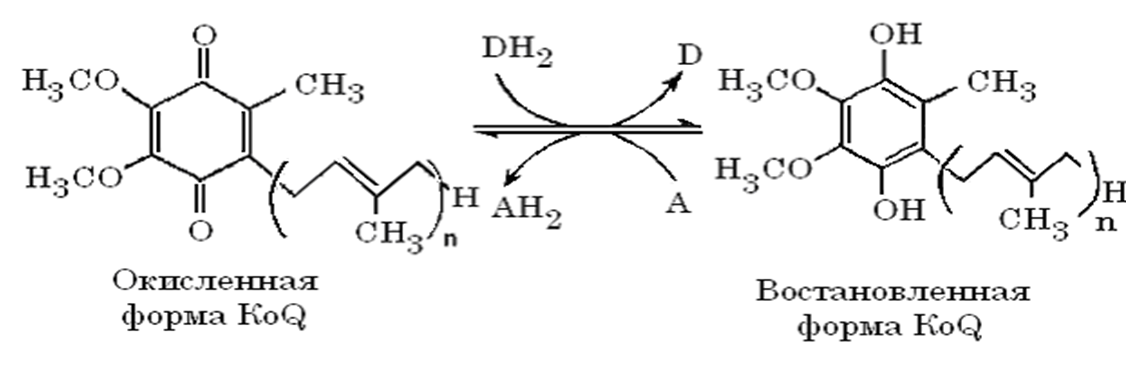
В дыхательной цепи окисленная форма убихинона в результате внутримолекулярного перемещения двойных связей переходит в восстановленную форму.
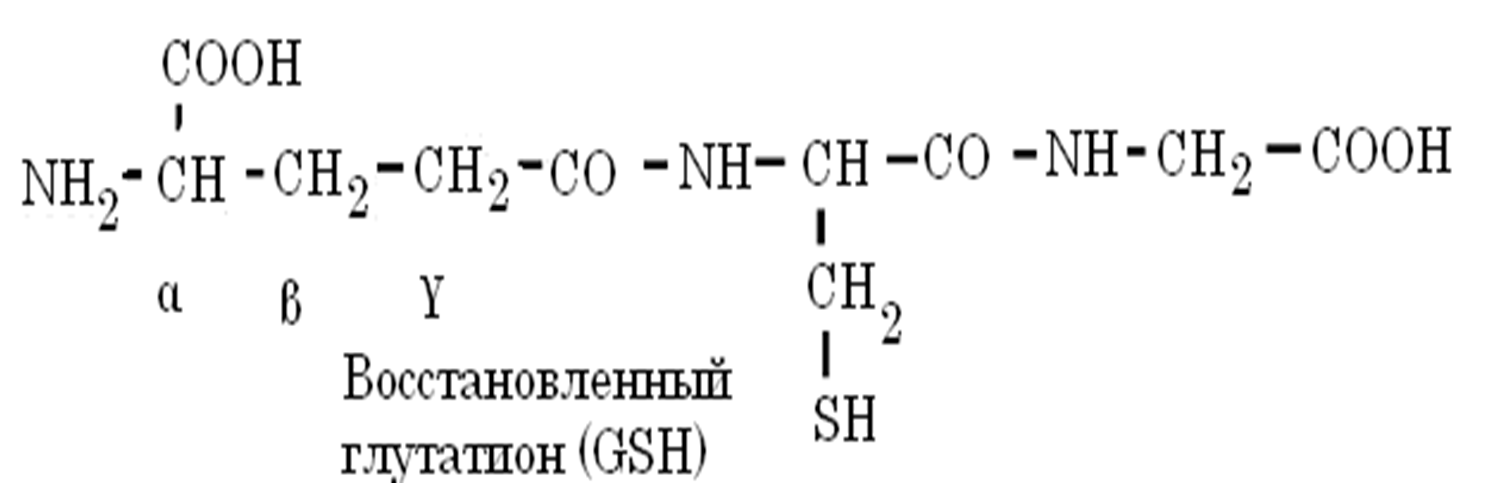
Глутатион
трипептид g-глутамилцистеинилглицин (GSН),
В окисленной форме глутатион - гексапептид (GSSG)
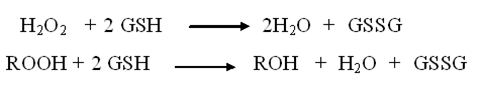
Восстановление пероксида водорода или органических пероксидов RООН с участием антиоксидантного фермента глутатионпероксидазы:
Как кофермент:
GSН участвует в реакции транспорта аминокислот через мембраны клеток.
Процесс катализируется трансферазным ферментом γ-глутамилтранспептидазой.
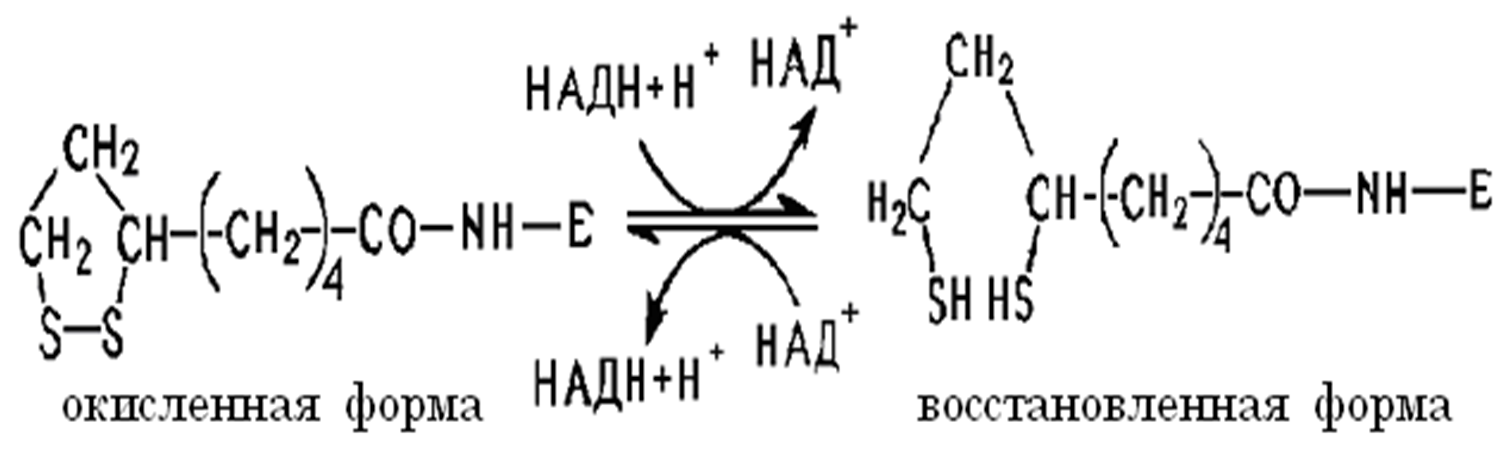
Липоевая кислота:
Как кофермент, амид липоевой кислоты участвует в окислительном декарбоксилировании пировиноградной кислоты в пируватдегидрогеназном комплексе и α-кетоглутаратдегидрогеназной реакции в цикле трикарбоновых кислот (ЦТК).
Окисленная форма содержит дисульфидную связь, которая разрывается при восстановлении с образованием сульфгидрильных групп SН.
Липоевая кислота в виде амида представлена окисленной и восстановленной формами, обратимо превращаемыми ферментом (Е) липоамиддегидрогеназой.
Порфириновые коферменты:
В цитохромах и каталазе изменения валентности Fе порфириновых коферментов (гема и его производных) связаны с обратимой окислительно-восстановительной реакцией, которую они катализируют.
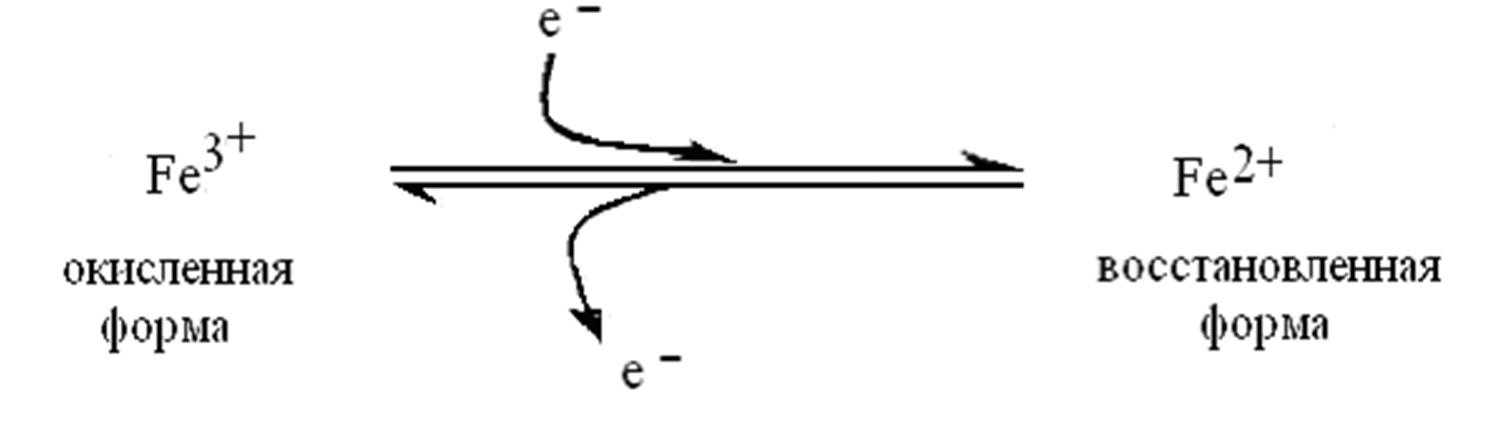
Электрон от донора присоединяется к Fе+3 гема.
Аскорбиновая кислота (витамин С)

Пищевые источники витамина С:
цитрусовые,
шиповник,
капуста,
черная смородина,
редька,
картофель,
помидоры
Витамин С:
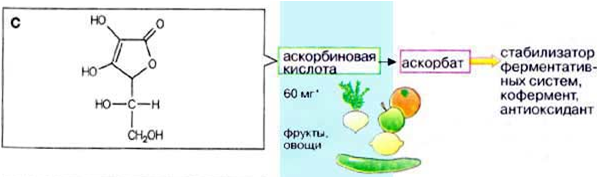
Функции витамина С:
стимулирует работу ЦНС,
улучшает общее самочувствие, настроение,
повышает сопротивляемость организма,
участвует в окислительно-восстановительных реакциях,
нормализует обмен холестерина,
способствует усвоению железа и нормальному кроветворению,
укрепляет кровеносные сосуды, кости, заживляет раны, участвуя в синтезе коллагена,
антиоксидант.
Как кофактор аскорбиновая кислота:
участвует совместно с кофактором Fе в созревании коллагена,
когда почти половина остатков пролина проколлагена после
синтеза на рибосоме гидроксилируется в гидроксипролин с
помощью пролилгидроксилазы, а остаток лизина гидроксилируется аналогично в гидроксилизин с помощью лизилгидроксилазы
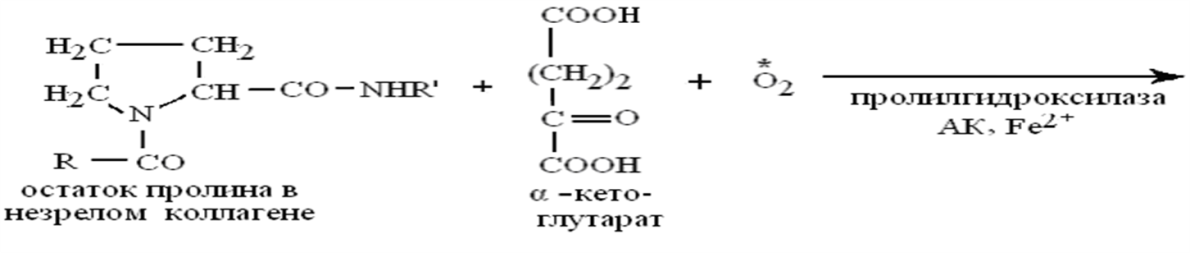
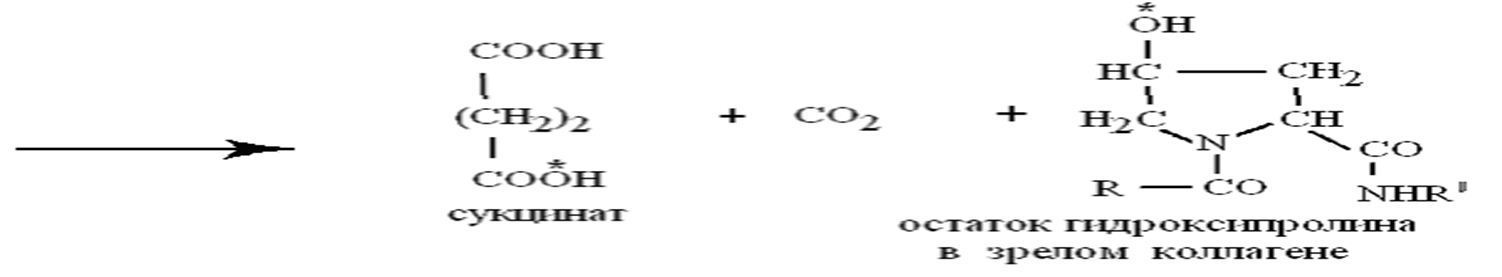
Враги витамина С
За 1 час стресса уничтожается
дневная норма витамина С.
Каждая сигарета «крадёт»
у организма 10 мг витамина С.
Различают следующие основные оксидоредуктазы:
аэробные дегидрогеназы или оксидазы, катализирующие перенос протонов(электронов) непосредственно на кислород;
Анаэробные дегидрогеназы, ускоряющие перенос протонов(электронов) на промежуточный субстрат, но не на кислород;
Цитохромы, катализирующие перенос только электронов.
К этому классу относят также гемосодержащие ферменты каталазу и пероксидазу,катализирующие реакции с участием перекиси водорода.
2. Гормональная регуляция углеводного обмена. Гормоны, повышающие и понижающие уровень глюкозы в крови. Механизм их действия.
Уровни регуляции содержания глюкозы в крови.
Регуляция содержания глюкозы в крови осуществляется на уровне:
субстрата,
регуляторных ферментов,
взаимодействия циклов (эффект Пастера),
ЦНС,
гормонов.
Гормоны, регулирующие углеводный обмен:
Гормоны, понижающие глюкозу крови:
инсулин.
Контринсулярнные гормоны:
адреналин,
глюкагон,
глюкокортикоиды,
тироксин,
СТГ.
Регуляция синтез и секреции инсулина и глюкагона:
Синтез и секреция инсулина и глюкагона регулируется глюкозой. При повышении концентрации глюкозы в крови секреция инсулина увеличивается, а глюкагона – уменьшается.
При пищеварении уровень инсулина высокий, а глюкагона – низкий.
В постабсорбтивный период уровень инсулина низкий, а глюкагона – высокий. Концентрация глюкозы в крови в этих условиях поддерживается за счёт процессов распада гликогена в печени и глюконеогенеза.
При голоде:
В течение 12-часового голодания гликоген печени – основной поставщик глюкозы.
Низкий инсулин – глюкагоновый индекс вызывает активацию гликогенфосфорилазы и мобилизацию гликогена.
Через сутки после последнего приёма пищи гликоген печени полностью исчерпан и глюконеогенез - единственный поставщик глюкозы в крови.
Адреналин:
активирует фосфорилазу мышц и печени,
тормозит синтез гликогена (подавляет гликогенсинтетазу),
стимулирует глюконеогенез из лактата,
активирует распад липидов в жировой ткани
Глюкагон:
активирует фосфорилазу печени,
активирует глюконеогенез из аминокислот, ускоряет протеолиз,
стимулирует распад жира в жировых депо,
тормозит синтез жира и холестерина.
Соматотропный гормон:
оказывает глюкозосберегающее действие за счёт активации липолиза,
осуществляет переключение на использование ВЖК,
тормозит транспорт глюкозы в клетку,
стимулирует секрецию инсулина и глюкагона.
Глюкокортикоиды:
активируют глюконеогенез из аминокислот,
стимулируют гликогенолиз,
тормозят потребление глюкозы тканями,
вызывают распад белков в мышцах, соединительной ткани лимфоцитах,
активируют распад липидов.
Тироксин:
усиливает всасывание глюкозы из кишечника,
тормозит синтез жира из глюкозы,
в больших дозах стимулирует распад белка, липидов, активирует глюконеогенез
Инсулин:
простой белок,
молекулярная масса 60 000,
содержит 51 АМК,
состоит из двух полипептидных цепей: α и ß.
α-цепь содержит 21 АМК, а ß -цепь – 30 АМК.
Синтез инсулина:
Синтезируется инсулин ß–клетками островков Лангерганса в виде проинсулина (84 АМК), который путём ограниченного протеолиза превращается в инсулин. При этом от проинсулина отщепляется С-пептид из 33АМК.
Секреция инсулина:
секреторная реакция ß-клеток на глюкозу является Са-зависимой,
СТГ, глюкагон и другие гормоны влияют на секрецию инсулина,
секреция возрастает при приёме богатой белками пищи (арг, лей).
Рецепторы инсулина:
обеспечивают реализацию эффектов инсулина на мишени,
вызывают активацию аденилатциклазы с образование цАМФ, который при участии ионов кальция и магния регулирует утилизацию глюкозы и синтез белка.
Различают свободный и связанный инсулин:
Свободный инсулин
- форма, которая хорошо реагирует с антителами к кристаллическому инсулину,
- стимулирует поглощение глюкозы жировой и мышечной тканями.
Связанный инсулин
- комплекс инсулина с белками сыворотки – трансферрином и α-глобулинами,
- резерв инсулина в русле крови
Метаболизм инсулина:
40-60 % инсулина метаболизируется в печени при участии инсулиназы,
40% инсулина расщепляется в почках.
Влияние инсулина на обменные процессы:
Инсулин – анаболик, стимулирует синтез:
гликогена,
белков,
нуклеиновых кислот,
липидов и тормозит их распад.
Действие инсулина:
повышает проницаемость клеточных мембран для глюкозы и усиливает потребление её тканями (активация белка-транспортера глюкозы),
активирует гексокиназную реакцию,
индуцирует синтез глюкокиназы,
активирует гликолиз,
активирует синтез гликогена, тормозит его распад,
активирует пентозный цикл,
активирует дихотомичексий распад глюкозы,
тормозит глюконеогенез,
при действии инсулина снижается концентрация цАМФ, повышается концентрация цГМФ,
в тканях стимулирует биосинтез нуклеотидов и нуклеиновых кислот,
стимулирует биосинтез жирных кислот, нейтрального жира (из углеводов),
усиливает биосинтез ДНК, РНК, АТФ,
оказывает белоксберегающее действие.
Значение инсулина:
анаболик,
противостоит группе контринсулярных гормонов,
регулирует уровень глюкозы в крови – 3,3-5,5 ммоль/л.
3. В крови снижено содержание мочевины. Нарушение какого метаболического пути можно предположить, каковы возможные причины этих нарушений?
Билет 18 орнитинов цикл,отсутствие ферментов
Билет 19.
1. Понятие об обмене веществ. Процессы анаболизма и катаболизма, их характеристика и взаимосвязь. Виды метаболических путей. Центральные метаболиты.
Обмен веществ и энергии-совокупность процессов превращения веществ и энергии в живых организмах и обмен веществами и энергией между организмом и окружающей средой.
Обмен веществ включает 3 этапа:
поступление веществ в организм,
метаболизм, или промежуточный обмен,
выделение конечных продуктов обмена.
Основные функции метаболизма:
извлечение энергии из окружающей среды (в форме химической энергии органических веществ),
превращение экзогенных веществ в строительные блоки,
сборка белков, нуклеиновых кислот, жиров из строительных блоков,
синтез и разрушение тех биомолекул, которые необходимы для выполнения различных специфических функций данной клетки.
Катаболизм- ферментативный распад высокомолекулярных соединений до составляющих их мономеров и дальнейший распад мономеров до конечных продуктов:
углекислого газа,
аммиака,
лактата.
Главные реакции катаболизма – реакции окисления, поставляющие клетке энергию.
Энергия может запасаться в двух формах:
АТФ,
НАДФН+Н - донор водорода в реакциях восстановления при синтезе ряда соединений.
Анаболизм:
ферментативный синтез основных макромолекул клетки, а также образование биологически активных соединений,
требует затраты свободной энергии (АТФ, НАДФН+Н ).
Отличия катаболизма и анаболизма:
Катаболизм – распад, запасание АТФ.
Анаболизм – синтез, но потребление АТФ.
Пути не совпадают, разное число реакций.
Отличаются по локализации.
Разная генетическая и аллостерическая регуляция.
Унификация питательных веществ идёт в три фазы:
