
Цитохромы Р450. Структура и функция
.docxЦитохромы Р450. Структура и функция
Среди ферментов 1-й фазы ведущее место занимает система цитохрома Р450 (P450 или CYP) с точки зрения каталитической активности в отношении огромного числа ксенобиотиков. Наибольшая концентрация цитохрома Р450 обнаруживается в эндоплазматическом ретикулуме гепатоцитов (микросомах). Печеночные микросомальные цитохромы Р450 играют важнейшую роль в определении интенсивности и времени действия чужеродных соединений и ключевую - в детоксикации ксенобиотиков, а также в активации их до токсичных и/или канцерогенных метаболитов. Цитохрома Р450-зависимые монооксигеназы – мультиферментная электрон-транспортная система. Все цитохромы Р450 - гемсодержащие белки. Обычно гемовое железо находится в окисленном состоянии (Fe3+). Восстанавливаясь до состояния Fe2+, цитохром Р450 способен связывать лиганды, такие как кислород или монооксид углерода. Комплекс восстановленного цитохрома Р450 с СО имеет максимум поглощения 450 nм, что и явилось основанием для
названия этих ферментов. Основная реакция, которую катализируют цитохромы Р450 – монооксигеназная, в которой один атом кислорода взаимодействует с субстратом (RH), а другой восстанавливается до Н2О. В качестве восстановителя в реакции участвует НАДФН:
RH (субстрат)+О2 + НАДФH + H+ --> ROH (продукт) + Н2О + НАДФ+
Механизм, благодаря которому цитохром получает электрон от НАДФH, зависит от внутриклеточной локализации цитохрома Р450. В ЭПР, где расположено большинство гемопротеидов, участвующих в биотрансформации ксенобиотиков, электрон передается через флавопротеин, называемый НАДФH-Р450 редуктаза. Одна молекула редуктазы может доставлять электроны на несколько различных молекул Р450. В митохондриях, где расположены итохромы Р450, участвующие в биосинтезе стероидных гормонов и метаболизме витамина D, электрон переносится с помощью 2-х белков: ферродоксина или ферродоксин-редуктазы.
На рис. 1 показан каталитический цикл цитохрома Р450. 1-я часть цикла заключается в активации кислорода, 2-я – в окислении субстрата. Схема действия микросомальной монооксигеназной системы впервые была описана Эстабруком с соавт., в настоящее время она подтверждена многими исследователями. Эта схема такова: первая стадия состоит во взаимодействии субстрата с окисленной формой Р450. При связывании Р450 с субстратами
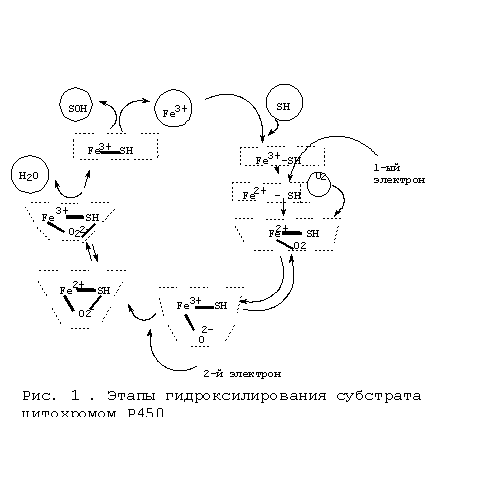
происходит переход гемового железа из низкоспинового в высокоспиновое состояние. Вторая стадия состоит в восстановлении образовавшегося фермент-субстратного комплекса первым электроном, который поступает с НАДФН-специфичной цепи переноса от НАДФН через
флавопротеид I (НАДФН-цитохром Р450 редуктазу). Третья стадия состоит в образовании тройного комплекса: восстановленный цитохрома Р450-субстрат-кислород. Четвертая стадия
представляет собой восстановление тройного комплекса вторым электроном, который, как
полагают, поступает из НАДН-специфичной цепи переноса электронов, состоящей из НАДН-
цитохром b5 редуктазы или флавопротеида II и цитохрома b5 . Пятая стадия состоит из нескольких процессов, включающих внутримолекулярные превращения восстановленного тройного комплекса и его распад с образованием гидроксилированного продукта и воды. На этой стадии цитохром Р450 переходит в исходную окисленную форму.
 Цитохромы
Р450 катализируют следующие типы реакций:
гидроксилирование алифатического или
ароматического атома углерода;
эпоксидирование двойной связи;
Цитохромы
Р450 катализируют следующие типы реакций:
гидроксилирование алифатического или
ароматического атома углерода;
эпоксидирование двойной связи;
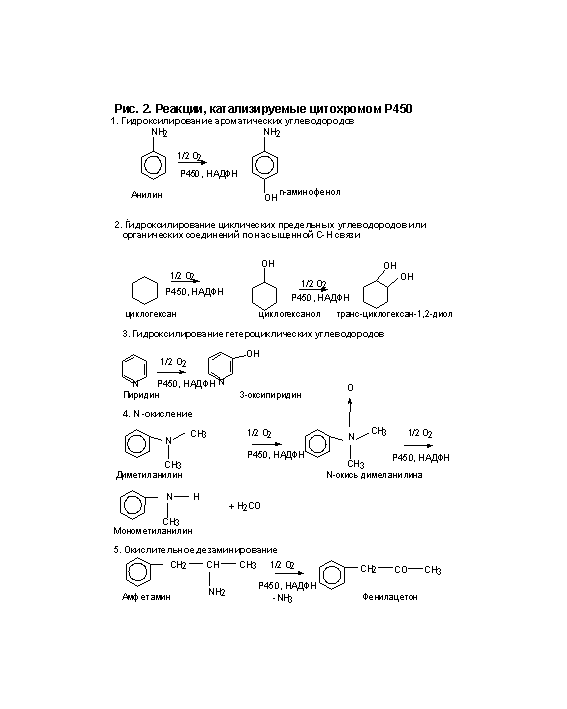
окисление атома (S, N, I) или N-гидроксилирование; перенос окисленной группы;
разрушение эфирной связи; дегидрогенирование. Некоторые реакции, катализируемые
цитохромом Р450, представлены на рис. 2 и 3. Несколько классов реагентов хорошо
иллюстрируют реакции фазы 1. Например, алканы гидроксилируются цитохромом Р450. Обычно
гидроксилируется последний углерод в цепи, так называемое омега- гидроксилирование. Так
же бывает внутреннее гидроксилирование в нескольких позициях (позиции -1,- 2).
 Это
приводит к множеству различных вариантов
продуктов даже с таким простым алканом,
как гексан. Заметим, что циклические
углеводороды тоже подвергаются
гидроксилированию. В реакции
гидроксилирования сначала образуется
полуацеталь, который потом превращается
в спирт и альдегид. При окислении алкенов
цитохромом Р450 образуются двуатомные
окиси. Они отличаются по своей стабильности
и могут являться высоко реакционноспособными.
Например, винилхлорид метаболически
переходит в окись, которая затем
превращается в хлорацетальдегид –
мутаген, действующий непосредственно
на ДНК. Эти исследования привели к
запрету на использование винилхлорида
в распылителях. Винильная группа стерина
(винилбензол) известна своими канцерогенными
свойствами, но организм человека способен
нейтрализовать его, переводя окись с
помощью фермента эпоксигидролазы в
диол. Но эпоксигидролаза помогает не
всегда. Например, цитохром Р450 синтезирует
эпоксид Афлотоксина В1 in vivо. Это
соединение – высоко реакционноспособный
электрофил, не стабилен и быстро формирует
аддукт с ДНК. К тому же диол, образующийся
из эпоксида, так же нестабилен и высоко
реакционноспособен. Окисление
ароматических соединений цитохромом
Р450 так же дает эпоксиды, но они быстро
переходят в фенол. В результате
гидроксилирования бензола, полученный
фенол может опять гидроксилироваться,
переходя в катехол или гидрохинон.
Заметим, что катехол и гидрохинон могут
реагировать с кислородом, подавляя
аналогичные реакции с хинонами и
супероксидами, которые являются
токсинами. Такое известное соединение
как 2,3,7,8-тетрахлордибензолдиоксин
(ТХДД) не подвержен гидроксилированию
и устойчив (период полураспада в организме
человека – год и более).
Это
приводит к множеству различных вариантов
продуктов даже с таким простым алканом,
как гексан. Заметим, что циклические
углеводороды тоже подвергаются
гидроксилированию. В реакции
гидроксилирования сначала образуется
полуацеталь, который потом превращается
в спирт и альдегид. При окислении алкенов
цитохромом Р450 образуются двуатомные
окиси. Они отличаются по своей стабильности
и могут являться высоко реакционноспособными.
Например, винилхлорид метаболически
переходит в окись, которая затем
превращается в хлорацетальдегид –
мутаген, действующий непосредственно
на ДНК. Эти исследования привели к
запрету на использование винилхлорида
в распылителях. Винильная группа стерина
(винилбензол) известна своими канцерогенными
свойствами, но организм человека способен
нейтрализовать его, переводя окись с
помощью фермента эпоксигидролазы в
диол. Но эпоксигидролаза помогает не
всегда. Например, цитохром Р450 синтезирует
эпоксид Афлотоксина В1 in vivо. Это
соединение – высоко реакционноспособный
электрофил, не стабилен и быстро формирует
аддукт с ДНК. К тому же диол, образующийся
из эпоксида, так же нестабилен и высоко
реакционноспособен. Окисление
ароматических соединений цитохромом
Р450 так же дает эпоксиды, но они быстро
переходят в фенол. В результате
гидроксилирования бензола, полученный
фенол может опять гидроксилироваться,
переходя в катехол или гидрохинон.
Заметим, что катехол и гидрохинон могут
реагировать с кислородом, подавляя
аналогичные реакции с хинонами и
супероксидами, которые являются
токсинами. Такое известное соединение
как 2,3,7,8-тетрахлордибензолдиоксин
(ТХДД) не подвержен гидроксилированию
и устойчив (период полураспада в организме
человека – год и более).
