
- •Химическая кинетика и катализ Кинетика химических реакций
- •Понятие о скоростихимической реакции. Закон действующих масс
- •Кинетическая классификация химических реакций. Понятие о молекулярности и порядке химической реакции Порядок и молекулярность простых химических реакций
- •Понятие о сложных химических реакциях
- •Классификация сложных реакций
- •Измерение скорости химической реакции
- •Влияние температуры на скорость химической реакции
- •Катализ Общие положения и закономерности катализа
- •Механизм гомогенного и гетерогенного катализа
- •Особенности каталитической активности ферментов
- •2. Другим важным отличием ферментов от катализаторов небелковой природы является их высокая специфичность, т.Е. Избирательность действия.
Измерение скорости химической реакции
Для экспериментального определения скорости химической реакции необходимо иметь данные об изменении концентрации исходных или конечных веществ во времени. Методы, с помощью которых это можно сделать, подразделяются на химическиеифизико-химические.
Химические методы основаны на непосредственном определении количества вещества или его концентрации в реакционном сосуде.
Чаще всего для этих целей используют такие виды количественного анализа, как титриметрия и гравиметрия. Если реакция протекает медленно, то для контроля за расходованием реагентов через определённые промежутки времени из реакционной среды осуществляют отбор пробы. Затем определяют в них содержание нужного вещества. Например, титрованием щёлочью определяют количество кислоты в системе по мере протекания реакции
R1 – COOH + R2 – OH → R1 – COO – R2 + H2O
Если реакция протекает с большой скоростью, то для отбора пробы её останавливают с помощью резкого охлаждения, быстрого удаления катализатора, разбавления либо перевода одного из реагентов в нереакционное состояние.
Химические методы анализа отличает простота, доступность и хорошая точность.
В современной экспериментальной кинетике чаще всего используют физико-химические методы анализа. Они позволяют контролировать изменение концентрации вещества непосредственно в ходе протекания реакции, не останавливая её и не делая отбора пробы.Эти методы основаны на измерении какого-либо физического свойства системы, меняющегося во времени и зависящего от количественного содержания в ней определённого соединения; например: давления (если в реакции участвуют газы), электропроводности, показателя преломления, спектра поглощения реагента или продукта реакции в ультрафиолетовой, видимой либо инфракрасной областях. Широко используются спектры электронного парамагнитного резонанса (ЭПР) и ядерного магнитного резонанса (ЯМР).
Применение спектральных методов основано на том, что поглощение электромагнитного излучения пропорционально количеству вещества или его концентрации в системе.
Обычно экспериментально изучают реакции в замкнутой системе (т.е. при постоянном объёме) и представляют результаты графически в виде так называемой кинетической кривой, выражающей зависимость концентрации реагента или продукта реакции от времениt. Аналитический вид этой зависимости называетсяуравнением кинетической кривой. В отличие от основного кинетического уравнения, уравнения кривых расходования реагирующих веществ (или накопления продуктов реакции) содержат в качестве параметров начальные концентрации компонентов (С0) в момент времениt=0.
Из этих уравнений выводят формулы для расчёта константы скорости реакции и времени полупревращения(t½) – промежутка времени, в течение которого расходуется половина взятого исходного вещества, т.е. его концентрация уменьшится в 2 раза и станет равной Со/2.
В реакциях нулевого порядка концентрация исходного вещества линейно уменьшается со временем (рис. 37)
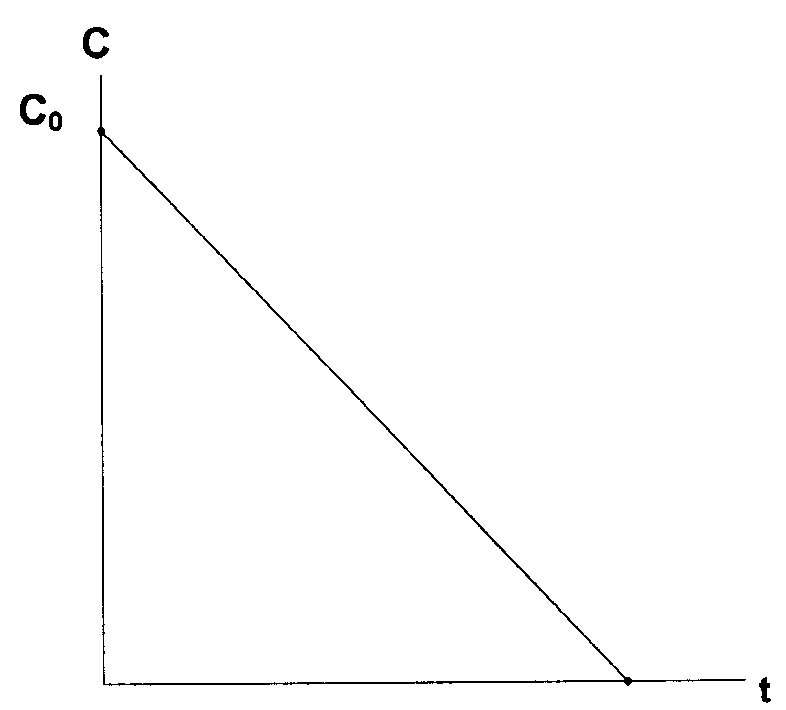
Рис. 37. Изменение концентрации исходного вещества от времени в реакции нулевого порядка
Математически данная линейная зависимость запишется следующим образом
С = С0–kt
где k – константа скорости, С0 – начальная молярная концентрация реагента, С – концентрация в момент времени t.
Из неё можно вывести формулу для расчёта константы скорости химической реакции нулевого порядка.
k
=
![]() (C0
– C).
(C0
– C).
Константа скорости нулевого порядка измеряется в моль/л ∙ с (моль · л-1· с-1).
Время полупревращения для реакции нулевого порядка пропорционально концентрации исходного вещества
t½=![]()
Для реакций первого порядка кинетическая кривая в координатах С, tносит экспоненциальный характер и выглядит следующим образом (рис. 38) Математически данная кривая описывается следующим уравнением
С = С0e-kt
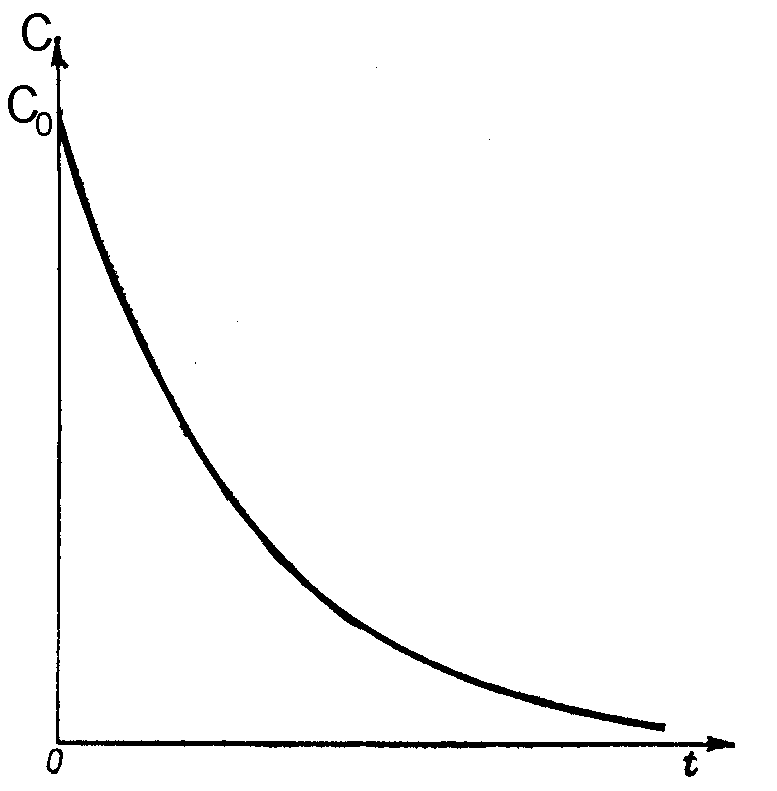
Рис. 38. Изменение концентрации исходного вещества от времени в реакции первого порядка
На практике для реакций первого порядка кинетическую кривую чаще всего строят в координатах ℓnC,t. В этом случае наблюдается линейная зависимость ℓnС от времени (рис. 39)
ℓnС = ℓnС0–kt
ℓnС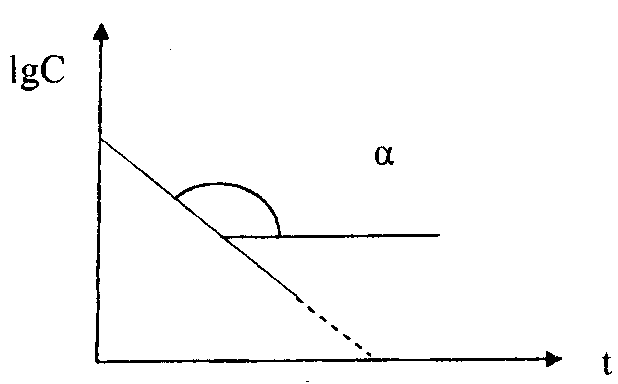
Рис. 39. Зависимость логарифма концентрации реагента от времени протекания для реакции первого порядка
Соответственно, величину константы скорости и время полупревращения можно рассчитать по следующим формулам
k
=
![]() ℓn
ℓn![]() илиk= 2,303
илиk= 2,303![]() ℓg
ℓg![]()
(при переходе от десятичного логарифма к натуральному).
t½
=![]()
Константа скорости реакции первого порядка имеет размерность t –1 , т.е. 1/с и не зависит от единиц измерения концентрации.Она показывает долю, которую составляют молекулы, вступившие в реакцию за единицу времени, от общего числа молекул реагента в системе. Таким образом, в реакциях первого порядка за одинаковые промежутки времени расходуются одинаковы доли взятого количества исходного вещества.
Второй отличительной особенностью реакций первого порядка является то, что t½ для них не зависит от начальной концентрации реагента, а определяется только константой скорости.
Вид уравнения зависимости концентрации от времени для реакций второго порядка рассмотрим только для простейшего случая, когда в элементарном акте участвуют 2 одинаковые молекулы, или молекулы разных веществ, но начальные концентрации их (С0) равны. При этом линейная зависимость наблюдается в координатах 1/С,t(рис. 40). Математическое уравнение этой зависимости запишется следующим образом
![]() =
=
![]() +kt
+kt
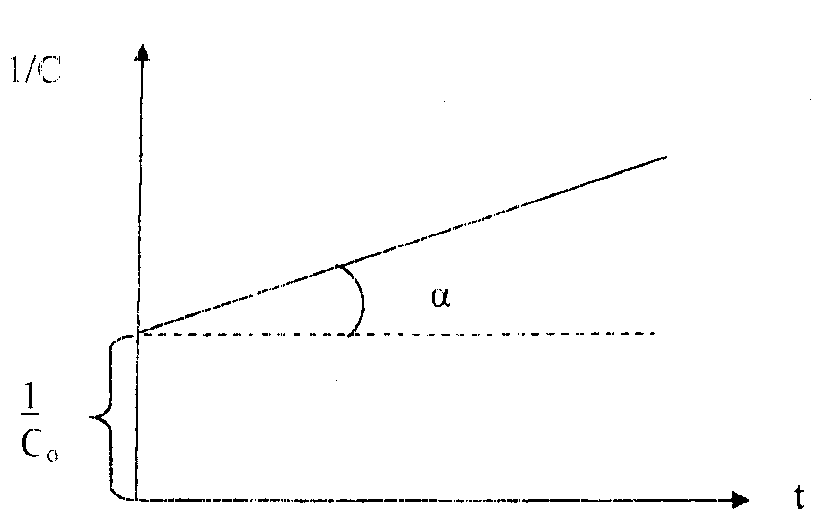
Рис. 40. Зависимость величины обратной концентрации реагента от времени для реакции второго порядка
Константа скорости вычисляется по формуле
k=
![]() (
(![]() –
–
![]() )
)
и измеряется в л∙с-1∙моль-1, т.е. ее численное значение зависит от того, в каких единицах измеряется концентрация вещества.
Период полупревращения реакций второго порядка обратно пропорционален начальной концентрации реагента
t½=![]()
Это связано с тем, что скорость реакций второго порядка в сильной мере зависит от числа столкновений между молекулами реагирующих веществ в единицу времени, которое, в свою очередь, пропорционально числу молекул в единице объема, т.е. концентрации вещества. Таким образом, чем больше концентрация вещества в системе, тем чаще сталкиваются молекулы между собой и тем за меньший промежуток времени половина их успеет прореагировать.
Реакции третьего порядка, как уже было сказано ранее, встречаются крайне редко и не представляют практического интереса. Поэтому в связи с этим мы их не будем рассматривать.
