
- •Применение закона действующих масс к растворам электролитов Электролитическая диссоциация Электролиты и неэлектролиты. Теория электролитической диссоциации
- •Общая характеристика электролитов
- •Слабые электролиты
- •Сильные электролиты
- •Теория кислот и оснований. Буферные растворы Теория кислот и оснований
- •Буферные растворы Определение буферных систем и их классификация
- •Механизм действия буферных систем
- •Вычисление рН и рОн буферных систем. Уравнение Гендерсона-Гассельбаха
- •Буферная емкость
- •Гетерогенные равновесия Константа растворимости. Правило растворимости осадков
- •1. Если стехиометрическое произведение молярных концентраций ионов труднорастворимого электролита в растворе равно величине егоKs (или пр) при данной температуре
- •2. Если стехиометрическое произведение молярных концентраций ионов в растворе электролита меньше величины его ks
- •3. В перенасыщенном растворе стехиометрическое произведение молярных концентраций труднорастворимого электролита больше величины его ks
- •Образование и растворение осадков
- •Однотипные и разнотипные конкурирующие равновесия в гетерогенных системах
- •Определение комплексных соединений и их общая характеристика
- •Строение комплексных соединений
- •Классификация комплексных соединений
- •Диссоциация комплексных соединений
- •Гидролиз солей
- •3. Соли, образованные сильной кислотой, но слабым основанием:
- •Количественный анализ основы титриметрического метода анализа Химический эквивалент
- •Молярная масса эквивалентов вещества
- •Химическое количество эквивалентов вещества
- •Молярная концентрация эквивалентов вещества
- •Закон эквивалентов
- •Титриметрический анализ Общая характеристика метода
- •Требования, предъявляемые к реакциям, которые используют в титриметрии
- •Способы титрования
- •Способы приготовления рабочих растворов
- •Правила работы с мерной посудой при проведении аналитических измерений
- •Мерные колбы
- •Пипетки
- •Бюретки
- •Проведение титрования
- •Кислотно-основное титрование Общая характеристика метода
- •Определение точки эквивалентности в кислотно-основном титровании. Кислотно-основные индикаторы
- •Подбор индикаторов при кислотно-основном титровании
- •Кривые титрования многоосновных (полипротонных) кислот, многокислотных оснований и их солей
- •Применение кислотно-основного титрования
- •Редоксиметрия Общая характеристика и классификация методов
- •Кривые титрования в редоксиметрии
- •Способы определения точки эквивалентности
- •Перманганатометрия
- •Иодометрия
- •Физико-химические методы анализа Практическое применение электропроводности
- •Потенциометрия
- •Хроматография Общая характеристика метода
- •Классификация хроматографических методов анализа
- •Методика разделения и идентификации компонентов смеси
- •Содержание
Образование и растворение осадков
Знание величины KSдля труднорастворимых веществ позволяет решать многочисленные вопросы, связанные с образованием или растворением осадков при химических реакциях, используемых в аналитической химии.
Покажем это на конкретных примерах.
Пример 1.Образуется ли осадокAg3PO4если к 5 см30,01М раствораK3PO4прилить 5 см30,01М раствораAgNO3(KS(Ag3PO4) = 1,3×10–20)
K3PO4 + 3 AgNO3 = Ag3PO4 + 3 KNO3
Решение. Чтобы ответить на этот вопрос, необходимо определить молярные концентрации ионов PO43– и Ag+ в получившемся растворе (в исходных растворах они были равны 0,01 моль/дм3).
При смешивании объем получившегося нового раствора удвоился, следовательно, молярные концентрации ионов PO43– и Ag+ уменьшились наполовину и стали равны по 0,005 или 5 × 10–3 моль/дм3 (считаем, что плотности исходных и конечного растворов равны 1 г/см3, т.к. они являются сильно разбавленными).
c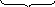 (PO43–)c3(Ag+)
= 5×10–3 (5×10–3)3 = 6,25×10–10> 1,3×10–20
(PO43–)c3(Ag+)
= 5×10–3 (5×10–3)3 = 6,25×10–10> 1,3×10–20
KS(Ag3PO4)
Стехиометрическое произведение молярных концентраций ионов соли Ag3PO4 оказалось больше величины ее KS. Это значит, что получившийся раствор является пересыщенным относительно Ag3PO4 и часть этой соли выпадет из него в осадок.
Пример 2.Образуется ли осадокAg3PO4, если 5 см30,00001 М раствораK3PO4смешать с 5 см30,00001 М раствораAgNO3?
Решение.В этом случае концентрации ионов PO43– и Ag+ в получившемся конечном растворе будут равны по 0,000005 или 5 × 10–6 моль/дм3.
c(PO43–)c3(Ag+)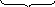 =
5×10–6(5×10–6)3= 6,25×10–22<
1,3×10–20
=
5×10–6(5×10–6)3= 6,25×10–22<
1,3×10–20
KS(Ag3PO4)
Стехиометрическое произведение молярных концентраций ионов соли оказалось меньше величины KS(Ag3PO4). Раствор является ненасыщенным относительно фосфата серебра, вследствие чего осадок не образуется.
Так как абсолютно нерастворимых веществ в воде нет, ни один из ионов электролита не может быть осажден из раствора полностью. Часть их всегда будет оставаться в жидкой фазе. Поэтому, чтобы добиться как можно более полного осаждения того или иного иона, необходимо из набора однотипных реагентов выбирать такой реактив, который давал бы с осаждаемым ионом осадок с наименьшим значением KS.
Так, например, ионы Ag+можно осадить из раствора с помощью следующего набора реагентов:Na2SO4,Na2CO3,Na2SO3,Na2S. Они образуют с ионами серебра однотипные осадки:
|
|
Ag2SO4 |
|
Ag2CO3 |
|
Ag2SO3 |
|
Ag2S |
|
|
KS=1,6×10–5 |
|
KS=1,2×10–3 |
|
KS=1,5×10–14 |
|
KS=6,3×10–50 |
Наиболее полное осаждение ионов Ag+ будет наблюдаться при добавлении к раствору сульфида натрия (или любой другой растворимой соли сероводородной кислоты), т.к. KS(Ag2S) имеет меньшее значение по сравнению с KS других осадков.
Если реагенты образуют с осаждаемым ионом труднорастворимые соединения разного типа, например: AgCl,Ag2CO3,Ag3PO4– руководствоваться при выборе наиболее полного осадителя только значениемKSнельзя. Необходимо определить, над каким из приведенных осадков равновесная концентрация ионовAg+(cAg+) будет наименьшей. Для этого, исходя из значенийKS, нужно рассчитать молярную растворимость (S) каждого осадка и умножить ее на число ионов серебра в его формульной единице:
|
AgCl |
|
Ag2CO3 |
|
Ag3PO4 |
|
KS=1,56×10–10 |
|
KS=1,2×10–12 |
|
KS=1,3×10–20 |
|
s=1,25×10–5 моль/дм3 |
|
s=6,69×10–5 моль/дм3 |
|
s=4,67×10–6 моль/дм3 |
|
с(Ag+)=1,25×10–5 моль/дм3 |
|
с(Ag+)=1,34×10–4 моль/дм3 |
|
с(Ag+)=1,4×10–5 моль/дм3 |
Как следует из представленных данных, наименьшая концентрация ионов Ag+в растворе будет над осадкомAgCl, это значит, что более полное осаждение ионовAg+наблюдается при добавлении к раствору любой растворимой соли соляной кислоты по сравнению с фосфатами и карбонатами.
В некоторых случаях ни один из имеющихся реагентов не дает достаточно полного высаждения требуемого иона из раствора вследствие заметной растворимости осадка. Тогда для исправления ситуации используют избыток реагента-осадителя.
Например, при добавлении к раствору CaCl2эквивалентного количестваNa2SO4наблюдается выпадение осадка
CaCl2+Na2SO4=CaSO4+ 2NaCl
Но при этом значительное количество ионов Ca2+(7,8×10–3 моль/дм3) будет оставаться в растворе, т.к.KS(CaSO4) = 6,110–5, т.е. имеет достаточно высокое значение для труднорастворимого вещества.
Если к данной равновесной системе (раствор–осадок) добавить еще некоторое количество K2SO4, то концентрация сульфат-ионов над осадкомCaSO4увеличится.
Но так как произведение молярных концентраций ионов Ca2+иSO42–должно оставаться постоянным, то часть равновесных ионовCa2+дополнительно выпадет из раствора в осадок (в соответствии с принципом Ле Шателье). Чем больше мы прибавим в систему дополнительного количества сульфата калия, тем больше станет концентрацияSO42–в растворе и тем меньше в нем останется неосажденных ионовCa2+.
Таким образом, для более полного осаждения какого-либо иона необходимо действовать избытком осаждающего реактива.При этом рекомендуется брать избыток последнего не более 50% (т.е. не больше чем в 1,5 раза от эквивалентного количества). В противном случае может происходить некоторое повышение растворимости осадка, связанное с так называемым «солевым эффектом». Он наблюдается при накоплении в жидкой фазе ионов, не входящих в состав осадка. Увеличение растворимости твердой фазы происходит вследствие возрастания ионной силы раствора. Коэффициенты активности () ионов труднорастворимого электролита в этом случае будут меньше единицы, для определенияKSуже необходимо использовать не молярные концентрации данных ионов (с), а их активностиа(а=c).
Если получившийся осадок может химически взаимодействовать с избытком реагента-осадителя с образованием растворимых соединений (например комплексных ионов):
AlCl3 + 3 NaOH = Al(OH)3 + 3 NaCl
Al(OH)3 + NaOH = Na[Al(OH)4]
то в подобных случаях следует вообще избегать избытка осаждающего реагента. Его нужно добавлять в строго эквивалентном количестве.
Наряду с высаждением тех или иных ионов из жидкой фазы на практике часто приходится решать и обратную задачу, т.е. перевод осадка в раствор для последующего определения его качественного и количественного состава.
Например, требуется осадок Mg(OH)2растворить, чтобы доказать в нем наличие ионовMg2+.
В жидкой фазе, находящейся над осадком вследствие установления равновесия
|
Mg(OH)2 |
|
Mg2+ + 2 OH– |
|
осадок |
|
жидкая фаза |
будут присутствовать ионы Mg2+иOH–, причемc(Mg2+)c2(OH–) = 5×10–12(табл. 14).
При добавлении в данную систему соляной кислоты образующиеся в ходе диссоциации ее молекул ионы H+, встречаясь в растворе с ионамиOH–(от растворившейся частиMg(OH)2), будут прочно связывать их в недиссоциированные молекулыH2O(ионное произведение водыKwравно 1×10–14). Вследствие этого стехиометрическое произведение молярных концентраций ионов осадка станет меньшеKS(Mg(OH)2).
c(Mg2+) c2(OH–) < KS(Mg(OH)2)
Раствор окажется ненасыщенным относительно гидроксида магния.
Система, стремясь восстановить нарушенное равновесие (согласно принципу Ле-Шателье), растворит дополнительную часть твердой фазы, т.е. Mg(OH)2и стехиометрическое произведение молярных концентраций ионовMg2+иOH–опять станет равнымKS(Mg(OH)2)
c(Mg2+) c2(OH–) = KS(Mg(OH)2) = 5 × 10–12
Но если прибавление кислоты продолжить, равновесие между осадком и его ионами в растворе будет постоянно нарушаться и все новые и новые порции Mg(OH)2станут переходить в раствор, пока осадок полностью не растворится.
Таким образом, чтобы вызвать растворение осадка, нужно непрерывно уменьшать в жидкой фазе концентрацию хотя бы одного из ионов, посылаемых им в раствор.Этого можно достичь, если связывать такой ион прибавляемым реактивом в более прочное слабодисоциирующее соединение (по сравнению с исходным осадком):
Mg(OH)2+ 2H+=Mg2++ 2 Н2О
В растворах сильных кислот растворяются все труднорастворимые в Н2О основания, а также многие нерастворимые соли слабых кислот, например:CaCO3,CaC2O4,CaSO3и др. В последнем случае образуются молекулы слабых кислот, которые удерживают анионы осадка прочнее, чем их соли:
 CO2
CO2
C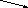 aCO3+ 2H+=Ca2++ Н2CO3
aCO3+ 2H+=Ca2++ Н2CO3
Н2О
Некоторые труднорастворимые в Н2О соли слабых кислот не растворяются даже в концентрированных сильных кислотах. Таковы, например:CuS,HgS,Ag2S. Константы растворимости этих солей крайне малы: 10–45– 10–52(табл. 14).
Поэтому концентрации ионов S2–в растворе над данными осадками будут всегда значительно меньше концентраций сульфид-ионов, образующихся за счет диссоциации молекул Н2S(Kдисс.(Н2S)=6×10–22.
Для растворения подобных осадков применяют другие способы. Например, окисляют ионы S2–до свободной серыS0или доS+4(SO2,SO32–). Это вызывает нарушение равновесия и растворение осадка.
Нерастворимые в Н2О соли сильных кислот, например,AgCl,AgBr,AgI,BaSO4, не растворяются в других сильных кислотах, т.к. при их добавлении не могут образоваться слабые электролиты. В этом случае используют реакции комплексообразования, т.е. соответствующим реактивом связывают катион соли в прочный комплексный ион:
AgCl + 2 NH3 = [Ag(NH3)2]+ + Cl–
(См. главу «Комплексные соединения»).
