
- •Введение
- •История изучения ферментов
- •Классификация
- •Скорость ферментативной реакции. Факторы, влияющие на ферментативную активность
- •Концентрация субстрата
- •Строение ферментов
- •Неорганические ионы (активаторы ферментов)
- •Простетические группы (фад, фмн, биотин, гем)
- •Коферменты (над, надф, кофермент а, атф)
- •Механизм действия ферментов Энергия активации. Принцип действия ферментов
- •Способы увеличения скорости реакции ферментами
- •Активный центр
- •Гипотеза “ключа и замка”. Гипотеза индуцированного соответствия
- •Свойства ферментов
- •Ферментативная кинетика Модель Михаэлиса-Ментен
- •График Лайнуивера-Бэрка в двойных обратных координатах
- •Ингибирование
- •Обратимое ингибирование
- •Конкурентное ингибирование
- •Неконкурентное ингибирование
- •Необратимое ингибирование
- •Аллостерические ферменты
- •Ингибирование конечным продуктом (ингибирование по принципу отрицательной обратной связи — ретроингибирование)
- •Регуляция активности фермента
- •Зимоген
- •Ковалентная модификация
- •Ингибирование по типу отрицательной обратной связи
- •Кооперативные эффекты
- •Симметричная модель
- •Последовательная модель
- •Аллостерическая регуляция
- •Глоссарий
- •Список использованной литературы
Скорость ферментативной реакции. Факторы, влияющие на ферментативную активность
Скорость ферментативной реакции
Мерой скорости ферментативной реакции служит количество субстрата, подвергшегося превращению в единицу времени, или количество образовавшегося продукта. Скорость определяют по углу наклона касательной к кривой на начальной стадии реакции.
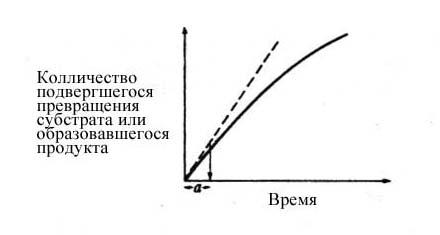
Рис. 2 Скорость ферментативной реакции.
Чем круче наклон, тем больше скорость. Со временем скорость реакции обычно снижается, по большей части в результате снижения концентрации субстрата.
Факторы, влияющие на ферментативную активность
Действие Ф. зависит от ряда факторов: температуры, реакции среды (pH), концентрации фермента, концентрации субстрата, от присутствия специфических активаторов и неспецифических или специфических ингибиторов.
Концентрация фермента
При высокой концентрации субстрата и при постоянстве других факторов скорость ферментативной реакции пропорциональна концентрации фермента.
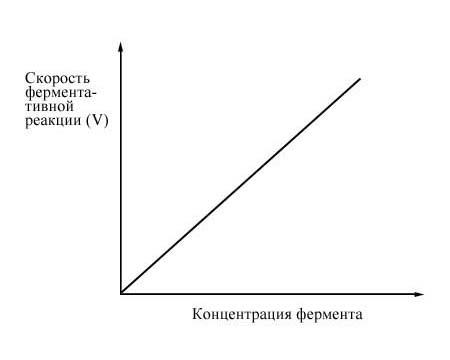
Рис. 3 Зависимость скорости ферментативной реакции от концентрации фермента.
Катализ осуществляется всегда в условиях, когда концентрация фермента гораздо ниже концентрации субстрата. Поэтому с возрастанием концентрации фермента растет и скорость ферментативной реакции.
Температура
Влияние температуры на скорость ферментативной реакции может быть выражено через температурный коэффициент Q10: Q10 = (скорость реакции при (х + 10)°C) / (скорость реакции при х °C)
В пределах 0-40°C Q10 ферментативной реакции равен 2. Иными словами, при каждом повышении температуры на 10°C скорость ферментативной реакции удваивается.
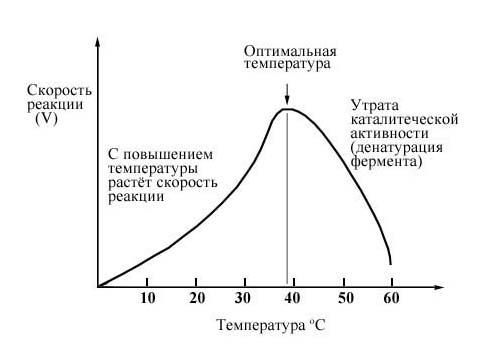
Рис. 4 Влияние температуры на активность такого фермента, как амилаза слюны.
С повышением температуры движение молекул ускоряется, и у молекул реагирующих веществ больше шансов столкнуться друг с другом. Увеличивается, следовательно, и вероятность того, что реакция между ними произойдет. Температура, обеспечивающая наибольшую активность, называется оптимальной. За пределами этого уровня скорость ферментативной реакции снижается, несмотря на увеличение частоты столкновений. Происходит это вследствие разрушения вторичной и третичной структур фермента, иными словами, вследствие того, что фермент претерпевает денатурацию.
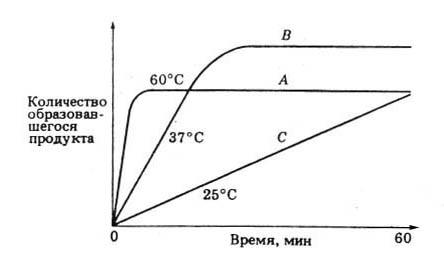
Рис. 5 Ход ферментативной реакции при разных температурах.
Когда температура приближается к точке замерзания или оказывается ниже ее, ферменты инактивируются, но денатурации при этом не происходит. С повышением температуры их каталитическая активность вновь восстанавливается.
Поскольку белки в сухом состоянии денатурируются значительно медленнее, чем белки оводненные (в виде белкового геля или раствора), инактивирование Ф. в сухом состоянии происходит гораздо медленнее, чем в присутствии влаги. Поэтому сухие споры бактерий или сухие семена могут выдержать нагревание до гораздо более высоких температур, чем те же споры или семена в увлажненном состоянии.
Концентрация субстрата
При данной концентрации фермента скорость ферментативной реакции возрастает с увеличением концентрации субстрата.
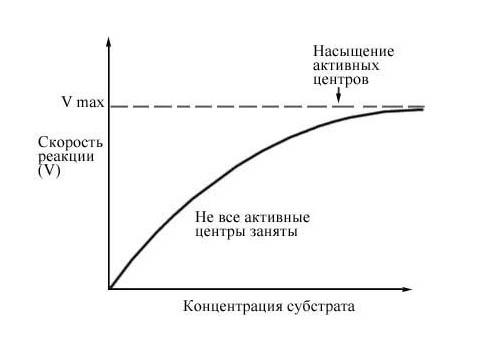
Рис. 6 Зависимость скорости ферментативной реакции от концентрации субстрата.
Теоретическая максимальная скорость реакции Vmax никогда не достигается, но наступает момент, когда дальнейшее увеличение концентрации субстрата уже не влечет за собой сколько-нибудь заметного изменения скорости реакции. Это следует объяснить тем, что при высоких концентрациях субстрата активные центры молекул Ф. в любой данный момент оказываются практически насыщенными. Таким образом, сколько бы ни было в наличии избыточного субстрата, он может соединиться с Ф. лишь после того, как образовавшийся ранее фермент-субстратный комплекс диссоциирует на продукт и свободный Ф. Поэтому при высоких концентрациях субстрата скорость ферментативной реакции лимитируется и концентрацией субстрата, и временем, которое требуется для диссоциации фермент-субстратного комплекса.
pH
При постоянной температуре любой Ф. работает наиболее эффективно в узких пределах pH. Оптимальным считается то значение pH, при котором реакция протекает с максимальной скоростью.
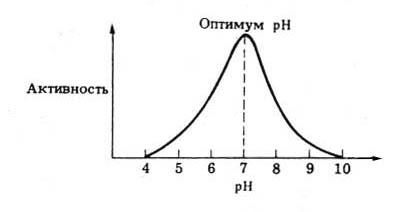
Рис. 7 Зависимость активности фермента от pH.
При более высоких и более низких pH активность Ф. снижается. Сдвиг pH меняет заряд ионизированных кислотных и основных групп, от которого зависит специфичная форма молекул Ф. В результате изменяется форма молекул Ф., и в первую очередь форма его активного центра. При слишком резких сдвигах pH Ф. денатурирует. Свойственный данному Ф. оптимум pH не всегда совпадает с pH его непосредственного внутриклеточного окружения. Это позволяет предположить, что среда, в которой находится Ф., в какой-то мере регулирует его активность.
|
Таблица 2. Оптимум pH для некоторых ферментов | |
|
Фермент |
Оптимум pH |
|
Пепсин |
2.00 |
|
Сахараза |
4.50 |
|
Энтерокиназа |
5.50 |
|
Амилаза слюны |
6.80 |
|
Каталаза |
7.60 |
|
Химотрипсин |
7.00-8.00 |
|
Липаза поджелудочной железы |
9.00 |
|
Аргиназа |
9.70 |
