
- •Предисловие
- •План лабораторных занятий по химии
- •Техника безопасности при работе в лаборатории химии общие правила проведения работ
- •Правила техники безопасности
- •Правила противопожарной безопасности
- •Меры первой помощи при несчастных случаях
- •Лабораторная работа № 1 получение и свойства неорганических соединений
- •Лабораторная работа № 2 молярная масса. Химический эквивалент
- •Лабораторная работа № 3 Основные закономерности протекания химических процессов
- •Лабораторная работа № 4 растворы
- •Лабораторная работа № 5 гидролиз солей. Произведение растворимости
- •Лабораторная работа № 6 Окислительно-восстановительные реакции
- •Лабораторная работа № 7 гальванические элементы. Коррозия металлов
- •Лабораторная работа № 8 электролиз
- •Лабораторная работа № 9
- •Лабораторная работа № 10
- •Часть 1. P-элементы III и IV групп (Алюминий. Углерод)
- •Часть 2. P-элементы V группы (Азот. Фосфор)
- •Часть 3. P-элементы VI группы (Сера)
- •Часть 4. Водород и р-элементы VII группы (Водород. Галогены)
- •Лабораторная работа № 11
- •Часть 1. D-элементы VI и VII групп (Хром. Марганец)
- •Часть 2. D-элементы VIII группы (Железо. Кобальт. Никель)
- •Лабораторная работа № 12 комплексные соединения
- •Лабораторная работа № 13 Поверхностные явления. Дисперсные системы
- •Лабораторная работа № 14 определение качественного и количественного состава веществ
- •Часть 1. Определение качественного состава веществ
- •Часть 2. Определение количественного состава веществ
- •Лабораторная работа № 15 качественный Элементный анализ органических соединений
- •Лабораторная работа № 16 Предельные и непредельные ациклические углеводороды
- •Лабораторная работа № 17 Ароматические углеводороды (арены)
- •Лабораторная работа № 18 Галогенопроизводные углеводородов
- •Лабораторная работа № 19 гидроксильные соединения (спирты. Фенолы)
- •Лабораторная работа № 20 карбонильные соединения (альдегидЫ. КетонЫ)
- •Лабораторная работа № 21 карбоновые кислоты и их производные
- •Лабораторная работа № 22 липиды (жиры и жироподобные соединения)
- •Лабораторная работа № 23 углеводы (моно-, ди- и полисахариды)
- •Лабораторная работа № 24 Азотсодержащие органические соединения
- •Часть 1. Амины, азосоединения
- •Часть 2. Аминокислоты. Белки
- •Лабораторная работа № 25 высокомолекулярные синтетические соединения (полимеры)
- •Приложения
- •1. Единицы измерения физических величин
- •2. Фундаментальные физические постоянные
- •3. Давление насыщенного водяного пара (р) в равновесии с водой
- •4. Произведение растворимости (пр) малорастворимых веществ при 25°c
Лабораторная работа № 2 молярная масса. Химический эквивалент
Цель работы
Изучение метода определения молярной массы вещества в газовом состоянии и способа определения молярной массы эквивалента металла по объему вытесняемого им водорода из соединений.
Оборудование и реактивы
Аппарат Киппа с двумя промывными склянками, весы технохимические и разновес, барометр, термометр, эвдиометр, вата, газоотводные трубки, кристаллизатор, мерный цилиндр, плоскодонная колба (200–250 мл) с пробкой, пробирки, резиновые трубки, спиртовка, спички, штатив, фильтровальная бумага.
Навеска металла около 0,2 г (Mg, Zn или Fe), перманганат калия KMnO4 (к); растворы: соляная кислота HCl (2 М), серная кислота H2SO4 (2 М), гидрокарбонат натрия NaHCO3 (насыщ.).
Экспериментальная часть
Опыт 1. Определение молярной массы диоксида углерода
Взвесьте на технохимических весах с точностью до 0,01 г колбу 200–250 мл с воздухом плотно закрытую пробкой (отметьте уровень пробки). Запишите массу колбы с воздухом: т1 = __________ (г).
Наполните колбу СО2 из аппарата Киппа (рис. 1), пропустив газ через промывные склянки с раствором NaHCO3 и конц. H2SO4. Через 4–5 мин, не закрывая крана у аппарата Киппа, выньте газоотводную трубку из колбы, закройте колбу пробкой и взвесьте колбу с СО2. Повторно заполните колбу СО2 и взвесьте. Результаты взвешиваний не должны расходиться более чем на 0,01 г. Иначе повторите наполнение и добейтесь постоянной массы колбы. Запишите массу колбы с СО2: т2 = __________ (г).
|
|
Рис. 1. Установка для получения диоксида углерода: 1 – аппарат Киппа; 2 – осушительные склянки с раствором NaHCO3 и конц. H2SO4; 3 – приемная колба |
Измерьте объем колбы, наполнив колбу водой до метки колбы и вылейте воду в мерный цилиндр. Запишите объем колбы: V = __________ (мл).
Запишите температуру опыта t = __________ °C и перевести ее в абсолютную температуру (Т = t + 273) Т = __________ К.
По показанию барометра отметьте атмосферное давление р = __________ (кПа).
Зная р, V, Т и используя уравнение Менделеева-Клапейрона, рассчитайте массу воздуха в колбе: т3 = 29 • p • V / (R • T) = ________________________________________ (г)
Рассчитайте массу колбы (с пробкой) без воздуха: m4 = m1 – m3 = ___________(г)
Определите массу СО2 в колбе: т5 = т2 – m4 = ___________________________ (г)
Приведите объем газа V к нормальным условиям (н.у.) по уравнению:
V0 • P0 / T0 = V • p / T,
где Т – температура (к); Vo – объем при То = 273 К и давлении р0 = 101,325 кПа.
________________________________________________________________________________
Вычислите молярную массу СО2:
1) по относительной плотности СО2 по воздуху
М(СО2) = m5 • M(возд.) / m3 = ____________________________________________(г)
2) по молярному объему газа:
М(СО2) = m5 • 22,4 / V0 = _______________________________________________ (г)
3) по уравнению Менделеева-Клапейрона:
М(СО2) = m5 • R • T / p • V = _____________________________________________ (г)
Вычислите среднее значение молярной массы по результатам трех расчетов с точностью до 0,01 г (Мпр) и относительный процент ошибки, подсчитав с точностью до 0,01 г теоретическое значение молярной массы СО2:
П = (Мтеор – Мпр) / Мтеор) • 100%
________________________________________________________________________________
________________________________________________________________________________
О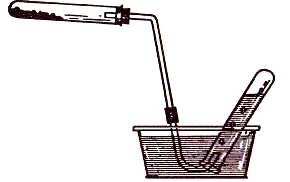 пыт
2. Определение
молярной
массы кислорода
пыт
2. Определение
молярной
массы кислорода
В сухую пробирку поместите 2–3 г KMnO4 (к), закройте тампоном из ваты и взвесьте на технических весах: m1 = _________ (г).
П
Рис. 2. Прибор для
сбора
газа вытеснением
воды
Нагрейте пробирку над спиртовкой до завершения реакции. Затем выньте, не прекращая нагревания, конец газоотводной трубки и охладите пробирку в течение 10–15 мин. Снимите пробку с газоотводной трубкой и взвесьте пробирку с оставшимся веществом и тампоном: m2 = _________ (г).
Измерьте объем выделившегося О2 в цилиндре V = _________ (мл) и с помощью миллиметровой линейки расстояние от уровня воды в кристаллизаторе до уровня воды в цилиндре Н = _________ (мм).
Запишите показания термометра t = _________ °C и барометра р = ________ мм рт. ст.
Приведите объем выделившегося кислорода к нормальным условиям, учитывая атмосферное давление (р), давление водяных паров при данной температуре (h) и давление столба жидкости (РВ), равное высоте жидкости (Н, мм), деленной на плотность ртути, т.е. РВ = Н / 13,6. Так как, парциальное давлении кислорода выражается формулой: РК = Р – (h + РВ), то формула для приведения объема кислорода к нормальным условиям примет вид:
V0 = V • PK • T0 /Р0 • T = V • [Р – (h + РВ)] •273 / Р0 •T
________________________________________________________________________________
По разности взвешивания определите массу кислорода: m0 = m1 – m2 = __________ (г).
Вычислите молекулярную массу кислорода: n = m/M; n = V0 / Vm;
M = m • Vm / V0= ________________________ (г/моль), учитывая, что Vm = 22400 мл.
Вычислите относительный процент ошибки, подсчитав теоретическое значение объема кислорода: П = (Vтеор – Vпр) / Vтеор) • 100%
________________________________________________________________________________
________________________________________________________________________________
Опыт 3. Определение молярной массы эквивалента металла
Наполните эвдиометр водой так, чтобы в градуированном цилиндре вода находилась на нулевом делении и в обоих цилиндрах на одинаковом уровне (рис. 3). Проверьте герметичность прибора – вставьте пробку в реакционную колбу и опустите уравнительный цилиндр на 15–20 см ниже его начального положения. Если прибор герметичен, то уровень воды в градуированном цилиндре несколько понизится и останется без изменения. При герметичности прибора уравнительный цилиндр поднимите в начальное положение.
|
|
Рис. 3. Эвдиометр: 1 – уравнительный цилиндр; 2 – градуированный цилиндр; 3 – резиновые трубки; 4 – резиновая пробка со стеклянной трубкой; 5 – реакционная колба |
Взвесьте кусочек металла (Mg, Zn или Fe) с точностью до 0,001 г: т = __________ (г). Рассчитайте по уравнению реакции Me + 2HCl = MeCl2 + H2. Какой объем разб. соляной кислоты (см. плотность кислоты) необходим для полного растворения металла?
________________________________________________________________________________
________________________________________________________________________________
Отмерьте полуторный объем кислоты по сравнению с требуемым и, не смачивая стенок горла колбы, вылейте кислоту в реакционную колбу. Поместите взвешенный металл, завернутый в фильтровальную бумагу, в горло колбы и плотно закройте колбу пробкой. Наклоните колбу, чтобы кусочек металла упал в колбу (реакция с железом требует подогрева, для этого реакционную колбу необходимо периодически погружать в баню с горячей водой). После окончания реакция оставьте прибор на 10 мин. для охлаждения газа до комнатной температуры.
Воду в градуированном и уравнительном цилиндрах приведите к одному уровню и, если в течение 1 мин не наблюдается изменения уровня, определите объем выделившегося водорода по делениям градуированного цилиндра: Vпр = ___________ (мл).
Запишите показания термометра t = ___________ °C и барометра р = ___________ кПа. Найдите давление насыщенного водяного пара при температуре опыта рН2О = ___________ кПа. Объем выделившегося водорода приведите к нормальным условиям:
![]() _________________________________________
_________________________________________
По данным опыта вычислите с точностью до 0,01 г молярную массу эквивалента металла M(1/zMe). Для этого рассчитать массу водорода по уравнению Менделеева-Клапейрона: т = p • V • M / (R • T) =____________________________________________(г), затем молярную массу эквивалента металла по закону эквивалентов:
 ____________________________________________
____________________________________________
Запишите данные в таблицу по форме:
|
т, г |
t, °C |
р, кПа |
рН2О, кПа |
Von, мл |
Vо, мл |
M(1/zMe) |
|
|
|
|
|
|
|
|
Сравните найденную величину молярной массы эквивалента металла с ее теоретическим значением и рассчитайте значение ошибки:
П = [Mтеор(1/zMe) – Mпр(1/zMe)] • 100% / Mтеор(1/zMe)
________________________________________________________________________________
Вывод: ___________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Контрольные задания
Какова мольная масса следующих веществ: HNO3, Al(OH)3, Cr2O3, FeSO4, K2SO4, Na3PO4, NaCl, K2CO3? Определите число молей, содержащихся в 200 г каждого вещества.
Сравните число молекул аммиака и диоксида углерода, содержащихся в каждом из этих веществ, взятых массой по 2 г.
Сколько молей диоксида углерода находится в воздухе объемом 100 м3 (н.у.), если объемная доля диоксида углерода в воздухе составляет 0,03%?
Сколько молей содержит любой газ объемом 1 м3 (н.у.)?
Вычислите объем газа (н.у.), если при 91 °С и давлении 98642 Па газ занимает объем 608 см3 .
Вычислите молекулярные массы газов, если: а) плотность газа по кислороду равна 0,50; б) плотность газа по азоту равна 0,93.
Какие газы тяжелее, а какие легче воздуха и во сколько раз: CO2, NO2, CO, Cl2, NH3?
Определите плотность газовой смеси по водороду, если смесь состоит из кислорода и азота объемами 56 дм3 и 28 дм3 (н.у.) соответственно.
Чему равна плотность по водороду светильного газа, имеющего следующий объемный состав: 48% H2, 32% CH4, 5% N2, 2% CO2, 4% C2H4, 9% CO?
Для паров одноосновной органической кислоты предельного ряда D(возд) = 4. Найдите мольную массу кислоты и напишите ее формулу.
При разложении карбоната металла(II) массой 21,0 г выделился СО2 объемом 5,6 дм3 (н.у.). Установите формулу соли.
Найдите формулы соединений, имеющих состав в массовых долях процента: а) серы – 40 и кислорода – 60; б) железа – 70 и кислорода – 30; в) хрома – 68,4 и кислорода – 31,6; г) калия – 44,9; серы – 18,4 и кислорода – 36,7; д) водорода – 13,05; кислорода – 34,78 и углерода – 52,17; е) магния – 21,83; фосфора – 27,85 и кислорода – 50,32.
Определите формулы соединений, имеющих состав в массовых долях процента: а) калия – 26,53; хрома – 35,35 и кислорода – 38,12; б) цинка – 47,8 и хлора – 52,2; в) серебра – 63,53; азота – 8,24 и кислорода – 28,23; г) углерода – 93,7; водорода – 6,3.
Определите простейшие формулы минералов, имеющих состав в массовых долях процента: а) меди – 34,6; железа – 30,4; серы – 35,0; б) кальция – 29,4; серы – 23,5; кислорода – 47,1; в) кальция – 40,0; углерода – 12,0; кислорода – 48,0; г) натрия – 32,9; алюминия – 12,9; фтора – 54,2.
Установите формулы: а) оксида ванадия, если оксид массой 2,73 г содержит металл массой 1,53 г: б) оксида ртути, если при полном разложении его массой 27 г выделяется кислород объемом 1,4 дм3 (н.у.)?
Чему равен эквивалентный объем (н.у.) кислорода, водорода и хлора?
При сгорании магния массой 4,8 г образовался оксид массой 8,0 г. Определите эквивалентную массу магния.
Определите эквивалентные массы олова в его оксидах, массовая доля кислорода в которых составляет 21,2% и 11,9%.
Массовая доля кислорода в оксиде свинца составляет 7,17%. Определите эквивалентную массу свинца.
Определите эквивалентную массу металла, если массовая доля серы в сульфиде составляет 22,15%, а эквивалентная масса серы равна 16 г/моль.
Пример. При 25 °С и давлении 99,3 кПа (745 мм рт. ст.) некоторый газ занимает объем 152 см3. Найдите, какой объем займет этот же газ при 0 °С и давлении 101,33 кПа?
Решение
|
Дано: to = 25 oC po = 99,3 кПа Vo = 152 см3 t = 0°С p = 101,33 кПа V – ? |
Решение: Р0/Р1 = V1/V0 или РV = const V1/T1 = V0/T0 или V/T = const PV/T = P0V0/T0, откуда V0 = PVT0/TP0 V0 = 99,3 • 152 • 273 / 101,33 • 298 = 136,5 см3 Ответ: 136,5 см3. |
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________


