
- •Министерство образования и науки российской федерации
- •«Тюменский государственный нефтегазовый университет» г.К.Севастьянова, т.М.Карнаухова Общая химия
- •Оглавление
- •1.2. Основные понятия химии
- •1.3. Основные законы химии
- •2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
- •2.1. Общие положения
- •2.2. Развитие представлений о строении атома
- •2.3. Квантово – механическая модель атома водорода. Исходные представления квантовой механики
- •2.4. Модель состояния электрона в атоме
- •2.5. Квантовые числа
- •2.6. Электронные конфигурации (формулы) элементов
- •2.7. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах
- •2.8. Электронные семейства элементов
- •2.9. Понятие об электронных аналогах
- •2.10. Периодический закон и периодическая система элементов д.И. Менделеева
- •2.11. Структура периодической системы химических элементов д. И. Менделеева
- •2.12. Периодическая система д.И. Менделеева и электронная структура атомов
- •2.13. Периодичность свойств элементов
- •3.Химическая связь и строение молекул
- •3.1. Основные понятия и определения
- •3.2. Теория метода валентных связей
- •3.3. Ковалентная связь
- •3.4. Насыщаемость ковалентной связи
- •3.5. Направленность ковалентной связи
- •3.6. Полярность и поляризуемость химической связи
- •3.7. Полярность молекул (типы ковалентных молекул)
- •3.8. Алгоритм выполнения заданий по теме «Химическая связь. Строение молекул»
- •3.8. Ионная связь
- •3.9. Металлическая связь
- •4. Основные классы неорганических соединений
- •4.1. Классификация веществ
- •4.2. Оксиды
- •4.3. Гидроксиды
- •4.4. Кислоты
- •4.5. Основания
- •4.6. Соли
- •5. Энергетика и направленность химических процессов (элементы химической термодинамики)
- •5.1 Основные понятия и определения
- •5.2. Первый закон термодинамики
- •5.3. Тепловой эффект химической реакции. Термохимия. Закон Гесса
- •5.4. Энтропия
- •5.5. Свободная энергия Гиббса
- •5.6. Свободная энергия Гельмгольца
- •6. Химическая кинетика
- •6.1. Основные понятия химической кинетики
- •6.2. Влияние природы реагирующих веществ
- •6.3. Закон действующих масс
- •6.4. Зависимость скорости химической реакции от температуры
- •6.5. Влияние катализатора
- •7. Химическое равновесие
- •7.1. Общие представления о химическом равновесии. Константа химического равновесия
- •7.2. Смещение химического равновесия. Принцип Ле Шателье
- •7.3. Фазовые равновесия. Правило фаз Гиббса
- •8. Дисперсные системы. Растворы
- •8.1. Дисперсные системы и их классификация
- •8.2. Общая характеристика растворов
- •8.3. Способы выражения концентрации растворов
- •8.4. Растворимость
- •8.5. Природа жидких растворов
- •8.6. Типы и свойства растворов
- •8.7. Свойства растворов неэлектролитов
- •8.8. Растворы электролитов
- •2. Температура.
- •3. Концентрация раствора.
- •4. Наличие одноименных ионов.
- •8.9. Равновесия и обменные реакции в растворах электролитов
- •8.10. Гидролиз солей
- •8.11. Комплексные соединения
- •9. Окислительно-восстановительные реакции
- •9.1. Общие понятия и определения
- •1. Метод электронного баланса.
- •2. Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
- •9.2. Восстановители и окислители
- •Важнейшие восстановители и окислители
- •9.3. Влияние среды на окислительно-восстановительные реакции
- •Кислая среда (рн 7)
- •9.4. Типы окислительно-восстановительных реакций
- •9.5. Окислительно – восстановительные (электродные) потенциалы
- •9.6. Направление протекания окислительно-восстановительных реакций
- •10. Электрохимические процессы
- •10.1. Гальванические элементы (химические источники электрического тока)
- •10.2. Электролиз
- •10.3. Коррозия металлов
- •10.4. Защита металлов от коррозии
- •11. Свойства металлов
- •11.1. Физические свойства металлов
- •11.2. Химические свойства металлов
- •Очень разб.
- •Литература
- •Приложение 1 Электронные конфигурации элементов
- •625000, Г. Тюмень, ул. Володарского, 38
- •625039, Г. Тюмень, ул. Киевская, 52
2.8. Электронные семейства элементов
В зависимости от того, какой подуровень последним заполняется электронами, все элементы делятся на четыре типа – электронные семейства:
s – элементы; заполняется электронами s – подуровень внешнего уровня. К ним относятся первые два элемента каждого периода. Валентными1являютсяs-электроны внешнего уровня.
p – элементы; заполняется электронами р – подуровень внешнего уровня. Это последние шесть элементов каждого периода (кроме I и VII). Валентными являются s- и p- электроны внешнего уровня.
d – элементы; заполняется электронами d – подуровень второго снаружи уровня, а на внешнем уровне – один или два электрона (y 46Pd – нуль). К ним относятся элементы вставных декад больших периодов, расположенных между s – и p – элементами (их также называют переходными элементами). Валентными являются s – электроны внешнего уровня и d – электроны предвнешнего уровня (второго снаружи).
f – элементы; заполняется электронами f – подуровень третьего снаружи уровня, а на внешнем уровне остается два электрона. Они расположены в 6 – м (4f – элементы) и 7 – м (5f – элементы) периодах периодической системы. 4f – элементы объединяют в семейство лантаноидов, а 5f – элементы – семейство актиноидов.
В периодической системе s – элементов 14, p – элементов 30, d – элементов 38, f – элементов 28.
2.9. Понятие об электронных аналогах
Атомы элементов с одинаковым заполнением внешнего энергетического уровня носят название электронных аналогов.Например:
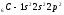 ;
;
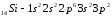 .
.
Элементы с одинаковым строением внешнего и предвнешнего энергетических уровней называют полными электронными аналогами.Например:
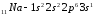 ;
;
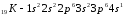 .
.
2.10. Периодический закон и периодическая система элементов д.И. Менделеева
Важнейшим событием химии в 19 веке было открытие периодического закона, сделанное в 1869 г. гениальным русским ученым Д. И. Менделеевым. Периодический закон в формулировке Д. И. Менделеева гласит: “ свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса”.
Графическим выражением этого закона стала созданная им периодическая система элементов.
В настоящее время известно несколько сотен вариантов периодической системы элементов, но все они в своей основе содержат предложенные Менделеевым принципы её построения. Наибольшее распространение получили короткая (восьмиклеточная) и длинная (тридцатидвухклеточная) формы периодической система элементов.
Развитие учения о строении атома вскрыло глубокий физической смысл периодического закона. Как было доказано, свойства элементов зависят, прежде всего, от заряда атомных ядер, который в свою очередь определяет распределение электронов на электронных оболочках атомов. Основной характеристикой атома является положительный заряд ядра, численно равный порядковому номеру элемента. В нейтральном атоме заряд ядра и общее число электронов равны. Распределением электронов на электронных оболочках атомов определяются свойства элементов и их соединений, положение элемента в периодической системе. Периодичность изменения свойств химических элементов и их соединений зависит от периодически повторяющейся сходной структуры электронных оболочек атомов.
В 1913 г. ученик Резерфорда английский ученый Мозли, исследуя спектры лучей Рентгена для различных элементов, установил простое соотношение между длиной волны рентгеновских лучей и порядковым номером элемента (закон Мозли):
Корень квадратный из величины, обратной длине волны рентгеновских лучей, испускаемых атомами различных элементов, находится в линейной зависимости от порядкового номера элемента, т. е.
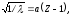
где – длина волны; Z – порядковый номер элемента; – постоянная, одинаковая для всех элементов.
Из уравнения следует, что, зная и измерив , можно вычислить порядковый номер элемента. Это экспериментальный метод проверки правильности распределения элементов в периодической системе по возрастанию заряда ядра. Закон Мозли показал, что Д.И. Менделеев правильно расположил элементы в периодической системе, позволил установить общее число элементов в каждом периоде, а главное, направил усилия ученых на открытие предсказанных им элементов. Вскоре несколько элементов было открыто с помощью анализа рентгеновских спектров (гафний, Z=72; рений, Z=75 и др.).
Вместе с тем из закона Мозли следует, что порядковый номер – это не простая нумерация элементов, а выражение конкретного внутреннего свойства атома – величины элементарных положительных зарядов ядра. Именно положительный заряд ядра (а не атомная масса) является главной характеристикой атома.
В свете современных представлений о строении атома изменилась и формулировка периодического закона: свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от величины заряда атомных ядер.
