
- •Министерство образования и науки российской федерации
- •«Тюменский государственный нефтегазовый университет» г.К.Севастьянова, т.М.Карнаухова Общая химия
- •Оглавление
- •1.2. Основные понятия химии
- •1.3. Основные законы химии
- •2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
- •2.1. Общие положения
- •2.2. Развитие представлений о строении атома
- •2.3. Квантово – механическая модель атома водорода. Исходные представления квантовой механики
- •2.4. Модель состояния электрона в атоме
- •2.5. Квантовые числа
- •2.6. Электронные конфигурации (формулы) элементов
- •2.7. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах
- •2.8. Электронные семейства элементов
- •2.9. Понятие об электронных аналогах
- •2.10. Периодический закон и периодическая система элементов д.И. Менделеева
- •2.11. Структура периодической системы химических элементов д. И. Менделеева
- •2.12. Периодическая система д.И. Менделеева и электронная структура атомов
- •2.13. Периодичность свойств элементов
- •3.Химическая связь и строение молекул
- •3.1. Основные понятия и определения
- •3.2. Теория метода валентных связей
- •3.3. Ковалентная связь
- •3.4. Насыщаемость ковалентной связи
- •3.5. Направленность ковалентной связи
- •3.6. Полярность и поляризуемость химической связи
- •3.7. Полярность молекул (типы ковалентных молекул)
- •3.8. Алгоритм выполнения заданий по теме «Химическая связь. Строение молекул»
- •3.8. Ионная связь
- •3.9. Металлическая связь
- •4. Основные классы неорганических соединений
- •4.1. Классификация веществ
- •4.2. Оксиды
- •4.3. Гидроксиды
- •4.4. Кислоты
- •4.5. Основания
- •4.6. Соли
- •5. Энергетика и направленность химических процессов (элементы химической термодинамики)
- •5.1 Основные понятия и определения
- •5.2. Первый закон термодинамики
- •5.3. Тепловой эффект химической реакции. Термохимия. Закон Гесса
- •5.4. Энтропия
- •5.5. Свободная энергия Гиббса
- •5.6. Свободная энергия Гельмгольца
- •6. Химическая кинетика
- •6.1. Основные понятия химической кинетики
- •6.2. Влияние природы реагирующих веществ
- •6.3. Закон действующих масс
- •6.4. Зависимость скорости химической реакции от температуры
- •6.5. Влияние катализатора
- •7. Химическое равновесие
- •7.1. Общие представления о химическом равновесии. Константа химического равновесия
- •7.2. Смещение химического равновесия. Принцип Ле Шателье
- •7.3. Фазовые равновесия. Правило фаз Гиббса
- •8. Дисперсные системы. Растворы
- •8.1. Дисперсные системы и их классификация
- •8.2. Общая характеристика растворов
- •8.3. Способы выражения концентрации растворов
- •8.4. Растворимость
- •8.5. Природа жидких растворов
- •8.6. Типы и свойства растворов
- •8.7. Свойства растворов неэлектролитов
- •8.8. Растворы электролитов
- •2. Температура.
- •3. Концентрация раствора.
- •4. Наличие одноименных ионов.
- •8.9. Равновесия и обменные реакции в растворах электролитов
- •8.10. Гидролиз солей
- •8.11. Комплексные соединения
- •9. Окислительно-восстановительные реакции
- •9.1. Общие понятия и определения
- •1. Метод электронного баланса.
- •2. Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
- •9.2. Восстановители и окислители
- •Важнейшие восстановители и окислители
- •9.3. Влияние среды на окислительно-восстановительные реакции
- •Кислая среда (рн 7)
- •9.4. Типы окислительно-восстановительных реакций
- •9.5. Окислительно – восстановительные (электродные) потенциалы
- •9.6. Направление протекания окислительно-восстановительных реакций
- •10. Электрохимические процессы
- •10.1. Гальванические элементы (химические источники электрического тока)
- •10.2. Электролиз
- •10.3. Коррозия металлов
- •10.4. Защита металлов от коррозии
- •11. Свойства металлов
- •11.1. Физические свойства металлов
- •11.2. Химические свойства металлов
- •Очень разб.
- •Литература
- •Приложение 1 Электронные конфигурации элементов
- •625000, Г. Тюмень, ул. Володарского, 38
- •625039, Г. Тюмень, ул. Киевская, 52
2.2. Развитие представлений о строении атома
До конца 19 века большинство учёных представляло атом как неразложимую и неделимую частицу элемента – "конечный узел" материи. Считалось также, что атомы неизменны: атом данного элемента ни при каких условиях не может превращаться в атом какого – либо другого элемента.
Конец 19 и начало 20 веков характеризуется новыми открытиями в физике и химии, изменившими взгляд на атом, как на неизменимую частицу, свидетельствовавшими о сложном составе атомов и о возможности их взаимопревращений.
Сюда относится, прежде всего, открытие электрона английским физиком Томсоном в 1897 г., открытие и изучение радиоактивности в конце 90 – х годов 19 в. А. Беккерелем, Марией и Пьером Кюри, Э. Резерфордом.
Примерно в начале ХХ в. исследования ряда явлений (излучений раскалённых тел, фотоэффект, атомные спектры) привели к выводу, что энергия распространяется и передаётся, поглощается и испускается не непрерывно, а дискретно, отдельными порциями – квантами. Энергия системы микрочастиц также может принимать только определённые значения, которые являются кратными числами квантов.
Предположение о квантовой энергии впервые было высказано М. Планком (1900). Энергия кванта Е пропорциональна частоте излучения ν:
Е=h·ν,
где h– постоянная Планка
(6,626 10-34Джс),
ν=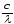 ,
с – скорость света,– длина волны.
,
с – скорость света,– длина волны.
В 1905 г. А. Эйнштейн предсказал, что любое излучение представляет собой поток квантов энергии, называемых фотонами. Из теории Эйнштейна следует, что свет имеет двойственную природу.
В 1911 г. Резерфорд предложил ядерную планетарную модель атома, состоящего из тяжёлого ядра, вокруг которого двигаются по орбитали электроны, подобно планетам солнечной системы. Однако, как показывает теория электромагнитного поля, электроны в этом случае должны двигаться по спирали, непрерывно излучая энергию, и падать на ядро.
Датский учёный Н. Бор, используя модель Резерфорда и теорию Планка, предложил первую квантовую модель (1913г.) строения атома водорода, согласно которой электроны двигаются вокруг ядра не по любым, а лишь по разрешённым орбитам, на которых электрон обладает определёнными энергиями. При переходе электрона с одной орбиты на другую атом поглощает или испускает энергию в виде квантов. Теория Бора позволила рассчитать энергию электронов, значения квантов энергии, испускаемых при переходе электрона с одного уровня на другой. Она не только объяснила физическую природу атомных спектров как результат перехода электронов с одних стационарных орбит на другие, но и впервые позволила рассчитывать спектры. Расчёт спектра простейшего атома – атома водорода, выполненный Бором, дал блестящие результаты: вычисленное положение спектральных линий в видимой части спектра совпало с их действительным местоположением в спектре. Но теория Бора не смогла объяснить поведение электрона в магнитном поле и все атомные спектральные линии, оказалась непригодной для многоэлектронных атомов. Возникла необходимость в новой модели атома, основанной на открытиях в микромире.
2.3. Квантово – механическая модель атома водорода. Исходные представления квантовой механики
В 1924г. Луи де Бройль (Франция) выдвинул предположение, что электрон, как и другие микрочастицы, характеризуется корпускулярно – волновым дуализмом. Де Бройль предложил уравнение, связывающее длину волны (λ) электрона или любой другой частицы с массой (m) и скоростью (v):
λ=h/(mv).
Волны частиц материи де Бройль назвал материальными волнами. Они свойственны всем частицам или телам, но, как следует из уравнения, для макротел длина волны настолько мала, что в настоящее время не может быть обнаружена. Так, для тела с массой 1000 кг, двигающегося со скоростью 108 км/ч (30 м/с), λ=2,21 10-38 м.
Гипотеза де Бройля была экспериментально подтверждена обнаружением дифракционного и интерференционного эффектов потока электронов. В настоящее время дифракция потоков электронов, нейтронов, протонов широко используется для изучения структуры веществ.
В 1927 г. В. Гейзенберг (Германия) постулировал принцип неопределённости, согласно которому положение и импульс движения субатомной частицы (микрочастицы) принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств. Э. Шредингер (Австрия) в 1926 г. вывел математическое описание поведения электрона в атоме. Сущность его заключается в том, что движение электронов в атоме описывается волновым уравнением, а определение местоположения электрона производится по вероятностным принципам. Уравнение Шредингера, являющееся основой современной квантово–механической теории строения атома, имеет вид (в простейшем случае):
–
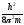 (
(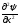 +
+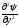 +
+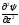 )
+U
)
+U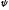 =E
=E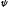 ,
,
где h– постоянная Планка;m– масса частицы;U– потенциальная энергия; Е – полная энергия;x,y,z– координаты; ψ – волновая функция.
Для характеристики состояния электрона особо важное значение имеет волновая функция ψ. Определённый физический смысл имеет её квадрат – ψ2. Величина ψ2dv выражает вероятность нахождения электрона в объёме пространства dv, окружающего атомное ядро. В настоящее время уравнение имеет точное решение только для водорода и водородоподобных частиц Не+, Li2+, т.е. для одноэлектронных частиц. Решение этого уравнения –задача сложная и рассмотрение её выходит за рамки данного курса.
Работы Планка, Эйнштейна, Бора, де Бройля, Гейзенберга, Шредингера заложили основу квантовой механики, изучающей движение и взаимодействие микрочастиц. Она основывается на представлении о квантовой энергии, волновом характере движения микрочастиц и вероятностном (статистическом) методе описания микрообъектов.
