
- •Министерство образования и науки российской федерации
- •«Тюменский государственный нефтегазовый университет» г.К.Севастьянова, т.М.Карнаухова Общая химия
- •Оглавление
- •1.2. Основные понятия химии
- •1.3. Основные законы химии
- •2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
- •2.1. Общие положения
- •2.2. Развитие представлений о строении атома
- •2.3. Квантово – механическая модель атома водорода. Исходные представления квантовой механики
- •2.4. Модель состояния электрона в атоме
- •2.5. Квантовые числа
- •2.6. Электронные конфигурации (формулы) элементов
- •2.7. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах
- •2.8. Электронные семейства элементов
- •2.9. Понятие об электронных аналогах
- •2.10. Периодический закон и периодическая система элементов д.И. Менделеева
- •2.11. Структура периодической системы химических элементов д. И. Менделеева
- •2.12. Периодическая система д.И. Менделеева и электронная структура атомов
- •2.13. Периодичность свойств элементов
- •3.Химическая связь и строение молекул
- •3.1. Основные понятия и определения
- •3.2. Теория метода валентных связей
- •3.3. Ковалентная связь
- •3.4. Насыщаемость ковалентной связи
- •3.5. Направленность ковалентной связи
- •3.6. Полярность и поляризуемость химической связи
- •3.7. Полярность молекул (типы ковалентных молекул)
- •3.8. Алгоритм выполнения заданий по теме «Химическая связь. Строение молекул»
- •3.8. Ионная связь
- •3.9. Металлическая связь
- •4. Основные классы неорганических соединений
- •4.1. Классификация веществ
- •4.2. Оксиды
- •4.3. Гидроксиды
- •4.4. Кислоты
- •4.5. Основания
- •4.6. Соли
- •5. Энергетика и направленность химических процессов (элементы химической термодинамики)
- •5.1 Основные понятия и определения
- •5.2. Первый закон термодинамики
- •5.3. Тепловой эффект химической реакции. Термохимия. Закон Гесса
- •5.4. Энтропия
- •5.5. Свободная энергия Гиббса
- •5.6. Свободная энергия Гельмгольца
- •6. Химическая кинетика
- •6.1. Основные понятия химической кинетики
- •6.2. Влияние природы реагирующих веществ
- •6.3. Закон действующих масс
- •6.4. Зависимость скорости химической реакции от температуры
- •6.5. Влияние катализатора
- •7. Химическое равновесие
- •7.1. Общие представления о химическом равновесии. Константа химического равновесия
- •7.2. Смещение химического равновесия. Принцип Ле Шателье
- •7.3. Фазовые равновесия. Правило фаз Гиббса
- •8. Дисперсные системы. Растворы
- •8.1. Дисперсные системы и их классификация
- •8.2. Общая характеристика растворов
- •8.3. Способы выражения концентрации растворов
- •8.4. Растворимость
- •8.5. Природа жидких растворов
- •8.6. Типы и свойства растворов
- •8.7. Свойства растворов неэлектролитов
- •8.8. Растворы электролитов
- •2. Температура.
- •3. Концентрация раствора.
- •4. Наличие одноименных ионов.
- •8.9. Равновесия и обменные реакции в растворах электролитов
- •8.10. Гидролиз солей
- •8.11. Комплексные соединения
- •9. Окислительно-восстановительные реакции
- •9.1. Общие понятия и определения
- •1. Метод электронного баланса.
- •2. Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
- •9.2. Восстановители и окислители
- •Важнейшие восстановители и окислители
- •9.3. Влияние среды на окислительно-восстановительные реакции
- •Кислая среда (рн 7)
- •9.4. Типы окислительно-восстановительных реакций
- •9.5. Окислительно – восстановительные (электродные) потенциалы
- •9.6. Направление протекания окислительно-восстановительных реакций
- •10. Электрохимические процессы
- •10.1. Гальванические элементы (химические источники электрического тока)
- •10.2. Электролиз
- •10.3. Коррозия металлов
- •10.4. Защита металлов от коррозии
- •11. Свойства металлов
- •11.1. Физические свойства металлов
- •11.2. Химические свойства металлов
- •Очень разб.
- •Литература
- •Приложение 1 Электронные конфигурации элементов
- •625000, Г. Тюмень, ул. Володарского, 38
- •625039, Г. Тюмень, ул. Киевская, 52
1. Метод электронного баланса.
Здесь подсчет числа присоединяемых и теряемых электронов производится на основании значений степеней окисления элементов до и после реакции. Обратимся к простейшему примеру:
Na0
+ Cl
Na+
Cl
Na+
Cl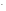
2 Na0 – eˉ Na+ –окисление
2
1
Cl2
+ 2eˉ
2 Cl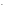 –восстановление
–восстановление
2
Na
+ Cl2
= 2Na+
+ 2Cl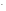
2 Na + Cl2 = 2NaCl
Данный метод используют в том случае, если реакция протекает не в растворе (в газовой фазе, реакции термического разложения и т.д.).
Алгоритм подбора коэффициентов в уравнениях ОВР методом электронного баланса:
Записать молекулярную схему реакции.
Определить с.о. элементов.
Отметить символы элементов, изменивших с.о. в ходе реакции.
На основании сравнения с.о. элементов, определить окислитель и продукт восстановления, восстановитель и продукт окисления.
Составить электронные уравнения процессов восстановления, окисления, соблюдая при этом баланс по элементам и зарядам.
Найти наименьшее общее кратное (НОК) для числа принятых и отданных электронов.
Найти основные коэффициенты при каждом электронном уравнении. Для этого полученное в пункте 6 число НОК разделить на число электронов, фигурирующих в данном электронном уравнении.
Умножить электронные уравнения на основные коэффициенты, полученные в п.7, и просуммировать их между собой (т.е. получить суммарное электронное уравнение). В суммарном уравнении электроны отсутствуют, т.к. сокращаются.
Подставить коэффициенты из суммарного электронного уравнения в молекулярное уравнение. Остальные коэффициенты подбираем в последовательности: соль, кислота или основание, вода.
Осуществить проверку числа атомов кислорода в правой и левой частях уравнения.
Примеры:
Молекулярная схемареакции:
+3 +2 0 +4
BiCl3 + Na2SnO2 + NaOH → Bi + NaCl + Na2SnO3 +H2O
ок-ль восст-ль продукт продукт
восст-ия ок-ия
Электронные уравнения:
|
осн. коэффициенты |
НОК |
|
|
|
2 |
6 |
Bi+3+3℮ =Bi |
процесс восстановления |
|
3 |
Sn+2 - 2℮ =Sn+4 |
процесс окисления | |
|
|
|
2 Bi+3+ 3Sn+2= 2Bi+3Sn+4 |
Суммарная схема электронного баланса |
Молекулярное уравнение реакции:
2BiCl3 + 3Na2SnO2 + 6NaOH → 2Bi + 6NaCl + 3Na2SnO3 +3H2O
Проверка:O: 12 = 12.
2. Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
Данный метод учитывает среду раствора, дает представление о характере частиц реально существующих и взаимодействующих в растворах. Остановимся на нем более подробно.
Алгоритм подбора коэффициентов в уравнениях ОВР методом ионно-электронного баланса:
1. Составить молекулярную схему реакции с указанием исходных веществ и продуктов реакции.
2. Составить полную ионно-молекулярную схему реакции, записывая слабые электролиты, малорастворимые, нерастворимые и газообразные вещества в молекулярном виде, а сильные электролиты – в ионном.
3. Исключив из ионно-молекулярной схемы ионы, не изменяющиеся в результате реакции (без учета их количества), переписать схему в кратком ионно-молекулярном виде.
4. Отметить элементы, изменяющие в результате реакции степень окисления; найти окислитель, восстановитель, продукты восстановления, окисления.
5. Составить схемы полуреакций окисления и восстановления, для этого:
а) указать восстановитель и продукт окисления, окислитель и продукт восстановления;
б) уравнять число атомов каждого элемента в левой и правой частях полуреакций (выполнить баланс по элементам) в последовательности: элемент, изменяющий степень окисления, кислород, другие элементы; при этом следует помнить, что в водных растворах в реакциях могут участвовать молекулы Н2О, ионы Н+ или ОН – в зависимости от характера среды:
|
Процесс |
Кислая среда |
Нейтральная среда |
Щелочная среда |
|
Связывание избытка кислорода |
О-2+2Н+=Н2О |
О-2+Н2О=2ОН ˉ |
О-2+Н2О=2ОН ˉ |
|
Восполнение недостатка кислорода |
Н2О= О-2+2Н+ |
Н2О = О-2+2Н+ |
2ОН ˉ=О-2+Н2О |
в) уравнять суммарное число зарядов в обеих частях полуреакций; для этого прибавить или отнять в левой части полуреакций необходимое число электронов (баланс по зарядам).
6. Найти наименьшее общее кратное (НОК) для числа отданных и полученных электронов.
7. Найти основные коэффициенты при каждой полуреакции. Для этого полученное в п.6 число (НОК) разделить на число электронов, фигурирующих в данной полуреакции.
8. Умножить полуреакции на полученные основные коэффициенты, сложить их между собой: левую часть с левой, правую – с правой (получить ионно-молекулярное уравнение реакции). При необходимости “привести подобные” ионы с учетом взаимодействия между ионами водорода и гидроксид-ионами: H++OH ˉ= H2O.
9. Расставить коэффициенты в молекулярном уравнении реакции.
10. Провести проверку по частицам, не участвующим в ОВР, исключенным из полной ионно-молекулярной схемы (п.3). При необходимости коэффициенты для них находят подбором.
11. Провести окончательную проверку по кислороду.
Примеры:
1. Кислая среда.
Молекулярная схема реакции:
KMnO4 + NaNO2 + H2SO4 MnSO4 + NaNO3 + H2O + K2SO4
Полная ионно-молекулярная схема реакции:
K++MnO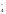 +
Na++NO
+
Na++NO +2H++
SO
+2H++
SO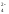
Mn2+
+ SO
Mn2+
+ SO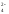 +
Na+
+ NO
+
Na+
+ NO +
H2O
+ 2K+
+SO
+
H2O
+ 2K+
+SO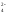 .
.
Краткая ионно-молекулярная схема реакции:
+7 +3 +5
MnO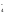 +NO
+NO +2H+
Mn2+
+
NO
+2H+
Mn2+
+
NO + H2O
+ H2O
ок-ль в-ль прод.в-ния прод.ок-ия
В
ходе реакции степень окисления Mn
понижается от +7 до +2 (марганец
восстанавливается), следовательно, MnО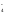 – окислитель;Mn2+
– продукт восстановления. Степень
окисления азота повышается от +3 до +5
(азот окисляется), следовательно, NO
– окислитель;Mn2+
– продукт восстановления. Степень
окисления азота повышается от +3 до +5
(азот окисляется), следовательно, NO –
восстановитель, NO
–
восстановитель, NO – продукт окисления.
– продукт окисления.
Уравнения полуреакций:
2 НОКMnO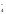 + 8H++ 5e-Mn2+
+ 4H2O–процесс
восстановления
+ 8H++ 5e-Mn2+
+ 4H2O–процесс
восстановления
10 +7 +(-5) = +2
5 NO + H2O– 2e-NO
+ H2O– 2e-NO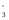 + 2H+–процесс
окисления
+ 2H+–процесс
окисления
-1 -(-2) = +1
2MnO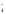 +
16H+
+ 5NO
+
16H+
+ 5NO +
5H2O
= 2Mn2+
+8H2O
+ 5NO
+
5H2O
= 2Mn2+
+8H2O
+ 5NO + 1OH+
(полное ионно-молекулярное уравнение).
+ 1OH+
(полное ионно-молекулярное уравнение).
В суммарном уравнении исключаем число одинаковых частиц, находящихся как в левой, так и в правой частях равенства (приводим подобные). В данном случае это ионы Н+ и Н2О.
Краткое ионно-молекулярное уравнение будет иметь вид
2MnO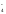 +
6H+
+
5NO
+
6H+
+
5NO
2Mn2+
+
3H2O
+ 5NO
2Mn2+
+
3H2O
+ 5NO .
.
В молекулярной форме уравнение имеет вид
2KMnO4 + 5 NaNO2 + 3 H2SO4 = 2MnSO4+5NaNO3 + 3H2O + K2SO4.
Проверка:
Баланс по частицам, которые не участвовали в ОВР: K+(2 = 2), Na+(5 = 5), SO
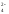 (3 = 3).
(3 = 3).Баланс по кислороду: 30 = 30.
2. Нейтральная среда.
Молекулярная схема реакции:
KMnO4
+ NaNO2
+ H2O
MnO2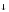 + NaNO3
+ KOH
+ NaNO3
+ KOH
Ионно-молекулярная схема реакции:
K+
+ MnO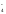 + Na+
+ NO
+ Na+
+ NO + H2O
MnO2
+ H2O
MnO2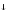 + Na+
+ NO
+ Na+
+ NO +
K+
+ OH
+
K+
+ OH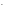
Краткая ионно-молекулярная схема:
+7 +3 +4 +5
MnO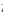 + NO
+ NO + H2O
MnO2
+ H2O
MnO2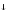 + NO
+ NO + OH-
+ OH-
ок-ль в-ль продукт в-ния продукт ок-ия
Уравнения полуреакций:
2 НОКMnO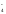 + 2H2O+ 3eˉMnO2
+ 2H2O+ 3eˉMnO2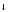 +4OH
+4OH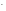 -процесс восстановления
-процесс восстановления
6 -1 +(-3)
= -4
3 NO +H2O– 2eˉNO
+H2O– 2eˉNO + 2H+-процесс
окисления
+ 2H+-процесс
окисления
-1 -
(-2) = +1
2MnO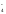 + 4H2O
+ 3NO
+ 4H2O
+ 3NO + 3 H2O
2MnO2
+ 3 H2O
2MnO2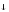
 + 8 OH-
+ 3NO
+ 8 OH-
+ 3NO + 6H+.
+ 6H+.
Приводим подобные, учитывая:
8
ОН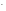
 +
6Н+
= 6Н2О
+ 2ОН
+
6Н+
= 6Н2О
+ 2ОН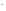 .
.
Краткое ионно-молекулярное уравнение:
2MnO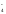 + 3NO
+ 3NO + H2O
2MnO2
+ H2O
2MnO2
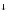 +
3NO
+
3NO + 2OH
+ 2OH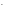 .
.
В молекулярной форме уравнение имеет вид
2KMnO4 + 3NaNO2 + H2O 2MnO2 + 3NaNO3 + 2KOH.
Проверка:
Баланс по кислороду: 15 = 15.
Баланс по частицам, которые не участвовали в ОВР: Na+ (3 = 3); K+ (2 = 2).
3. Щелочная среда.
Молекулярная схема реакции:
KMnO4 + NaNO2 + KOH K2MnO4 + NaNO3 + H2O.
Ионно-молекулярная схема реакции:
K++MnO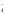 + Na++NO
+ Na++NO + K++
OH
+ K++
OH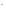
2K++MnO
2K++MnO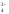 + Na++NO
+ Na++NO + H2O.
+ H2O.
Краткая ионно-молекулярная схема реакции:
+7 +3 +6 +5
MnO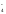 + NO
+ NO +OH
+OH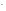
MnO
MnO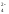 + NO
+ NO + H2O
+ H2O
oк-ль в-ль продукт в-ния продукт ок-ия
Уравнения полуреакций:
2 НОКMnO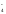 + 1e-MnO
+ 1e-MnO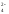 –процесс
восстановления
–процесс
восстановления
2
1 NO + 2OH
+ 2OH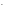 - 2e-NO
- 2e-NO +H2O–процесс окисления
+H2O–процесс окисления
-3 -
(-2) = -1
2
MnO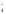 + NO
+ NO +2OH
+2OH
2MnO
2MnO + NO
+ NO + H2O
(краткое ионно-молекулярное уравнение).
+ H2O
(краткое ионно-молекулярное уравнение).
В молекулярной форме уравнение имеет вид
2KMnO4 + NaNO2 + 2KOH 2K2MnO4 + NaNO3 + H2O
Проверка:
Баланс по кислороду: 12 = 12.
Баланс по частицам, которые не участвовали в ОВР: К+ (4 = 4); Na+ (1 = 1).
