
- •Министерство образования и науки российской федерации
- •«Тюменский государственный нефтегазовый университет» г.К.Севастьянова, т.М.Карнаухова Общая химия
- •Оглавление
- •1.2. Основные понятия химии
- •1.3. Основные законы химии
- •2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
- •2.1. Общие положения
- •2.2. Развитие представлений о строении атома
- •2.3. Квантово – механическая модель атома водорода. Исходные представления квантовой механики
- •2.4. Модель состояния электрона в атоме
- •2.5. Квантовые числа
- •2.6. Электронные конфигурации (формулы) элементов
- •2.7. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах
- •2.8. Электронные семейства элементов
- •2.9. Понятие об электронных аналогах
- •2.10. Периодический закон и периодическая система элементов д.И. Менделеева
- •2.11. Структура периодической системы химических элементов д. И. Менделеева
- •2.12. Периодическая система д.И. Менделеева и электронная структура атомов
- •2.13. Периодичность свойств элементов
- •3.Химическая связь и строение молекул
- •3.1. Основные понятия и определения
- •3.2. Теория метода валентных связей
- •3.3. Ковалентная связь
- •3.4. Насыщаемость ковалентной связи
- •3.5. Направленность ковалентной связи
- •3.6. Полярность и поляризуемость химической связи
- •3.7. Полярность молекул (типы ковалентных молекул)
- •3.8. Алгоритм выполнения заданий по теме «Химическая связь. Строение молекул»
- •3.8. Ионная связь
- •3.9. Металлическая связь
- •4. Основные классы неорганических соединений
- •4.1. Классификация веществ
- •4.2. Оксиды
- •4.3. Гидроксиды
- •4.4. Кислоты
- •4.5. Основания
- •4.6. Соли
- •5. Энергетика и направленность химических процессов (элементы химической термодинамики)
- •5.1 Основные понятия и определения
- •5.2. Первый закон термодинамики
- •5.3. Тепловой эффект химической реакции. Термохимия. Закон Гесса
- •5.4. Энтропия
- •5.5. Свободная энергия Гиббса
- •5.6. Свободная энергия Гельмгольца
- •6. Химическая кинетика
- •6.1. Основные понятия химической кинетики
- •6.2. Влияние природы реагирующих веществ
- •6.3. Закон действующих масс
- •6.4. Зависимость скорости химической реакции от температуры
- •6.5. Влияние катализатора
- •7. Химическое равновесие
- •7.1. Общие представления о химическом равновесии. Константа химического равновесия
- •7.2. Смещение химического равновесия. Принцип Ле Шателье
- •7.3. Фазовые равновесия. Правило фаз Гиббса
- •8. Дисперсные системы. Растворы
- •8.1. Дисперсные системы и их классификация
- •8.2. Общая характеристика растворов
- •8.3. Способы выражения концентрации растворов
- •8.4. Растворимость
- •8.5. Природа жидких растворов
- •8.6. Типы и свойства растворов
- •8.7. Свойства растворов неэлектролитов
- •8.8. Растворы электролитов
- •2. Температура.
- •3. Концентрация раствора.
- •4. Наличие одноименных ионов.
- •8.9. Равновесия и обменные реакции в растворах электролитов
- •8.10. Гидролиз солей
- •8.11. Комплексные соединения
- •9. Окислительно-восстановительные реакции
- •9.1. Общие понятия и определения
- •1. Метод электронного баланса.
- •2. Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
- •9.2. Восстановители и окислители
- •Важнейшие восстановители и окислители
- •9.3. Влияние среды на окислительно-восстановительные реакции
- •Кислая среда (рн 7)
- •9.4. Типы окислительно-восстановительных реакций
- •9.5. Окислительно – восстановительные (электродные) потенциалы
- •9.6. Направление протекания окислительно-восстановительных реакций
- •10. Электрохимические процессы
- •10.1. Гальванические элементы (химические источники электрического тока)
- •10.2. Электролиз
- •10.3. Коррозия металлов
- •10.4. Защита металлов от коррозии
- •11. Свойства металлов
- •11.1. Физические свойства металлов
- •11.2. Химические свойства металлов
- •Очень разб.
- •Литература
- •Приложение 1 Электронные конфигурации элементов
- •625000, Г. Тюмень, ул. Володарского, 38
- •625039, Г. Тюмень, ул. Киевская, 52
2. Температура.
У сильных электролитов с повышением температуры степень диссоциации уменьшается, у слабых – при повышении температуры до 60°С α увеличивается, а затем начинает уменьшаться.
3. Концентрация раствора.
Если рассматривать диссоциацию как равновесный химический процесс, то в соответствии с принципом Ле Шателье добавление растворителя (разбавление водой), как правило, увеличивает количество продиссоциированных молекул, что приводит к увеличению α. Процесс образования молекул из ионов в результате разбавления затрудняется: для образования молекулы должно произойти столкновение ионов, вероятность которого с разбавлением уменьшается.
4. Наличие одноименных ионов.
Добавление одноименных ионов уменьшает степень диссоциации, что также согласуется с принципом Ле Шателье. Например, в растворе слабой азотистой кислоты при электролитической диссоциации устанавливается равновесие между недиссоциированными молекулами и ионами:
НNО2 Н+ + NО2ˉ.
При введении в раствор азотистой кислоты нитрит-ионов NO2ˉ (прибавлением раствора нитрита калия КNО2) равновесие сместится влево, следовательно, степень диссоциации α уменьшится. Аналогичный эффект даст и введение в раствор ионов Н+.
Необходимо отметить,
что не следует
путать понятия «сильный электролит» и
«хорошая растворимость».
Например, растворимость СН3СООН
в Н2О
неограниченная, однако уксусная кислота
относится к слабым электролитам (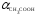 =
0,014 в 0,1 М растворе). С другой стороны,
ВаSО4
–нерастворимая соль (при 20°С растворимость
меньше 1 мг в 100 г Н2О),
но относится к сильным электролитам,
так как все молекулы, перешедшие в
раствор, распадаются на ионы Ва2+
и SО42-.
=
0,014 в 0,1 М растворе). С другой стороны,
ВаSО4
–нерастворимая соль (при 20°С растворимость
меньше 1 мг в 100 г Н2О),
но относится к сильным электролитам,
так как все молекулы, перешедшие в
раствор, распадаются на ионы Ва2+
и SО42-.
8.9. Равновесия и обменные реакции в растворах электролитов
Теория слабых электролитов. Константа диссоциации. В растворах слабых электролитов процесс диссоциации протекает обратимо, т.е. идет до установления состояния равновесия, следовательно, к нему может быть применен закон действующих масс для обратимых процессов.
Обратимый процесс диссоциации слабого электролита характеризуется константой равновесия.
Так, для процесса диссоциации слабого электролита
КmАn mКn+ + nАm–
можно записать константу равновесия:

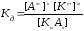 ,
,
КД
где [Кn+], [Аm–], [КmАn] – равновесные концентрации компонентов; m и n – стехиометрические коэффициенты компонентов в уравнении диссоциации; Кд – константа равновесия для процесса диссоциации слабого электролита, называемая константой диссоциации..
Например, для процесса диссоциации уксусной кислоты
СН3СООН СН3СОО- + Н+
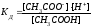 .
.
Кд представляет собой важную характеристику слабых электролитов, т.к. указывает на прочность их молекул в данном растворе. Чем меньше Кд в данном растворителе, тем слабее диссоциирует электролит и тем, следовательно, устойчивее его молекулы. Кд – табличная величина.
Как и любая константа равновесия, константа диссоциации зависит от природы растворенного вещества и растворителя, от температуры и не зависит от концентрации раствора.
С повышением температуры константа диссоциации обычно уменьшается. Например, константа диссоциации уксусной кислоты при 293, 298 и 373 К соответственно равна 1,85·10-5, 1,75·10-5, 1,35·10-5 (т.е. процесс диссоциации является экзотермическим).
Следует отметить, что строго законы химического равновесия применимы только к слабым электролитам, поэтому описание электролитической диссоциации законом действующих масс является одним из основных признаков слабых электролитов.
Между Кд и α существует количественная зависимость. Примем для процесса диссоциации бинарного электролита
КА К+ + А–
молярную концентрацию растворенного вещества КА равной С, а степень диссоциации α, тогда равновесные концентрации ионов в растворе будут равны [А-] = [К+] = αС, а равновесная концентрация недиссоциированных молекул [КА] = С – αС, то
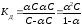 ,
,
где (1-α) – доля недиссоциированных молекул вещества. Полученное соотношение называется законом разбавления Оствальда. В случае слабых электролитов если α<<1, то
 и
и
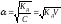 ;
;
здесь
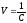 – разбавление раствора.
– разбавление раствора.
Значения Кд для разных электролитов приведены в справочной литературе.
Для расчетов, связанных с диссоциацией кислот, часто удобно пользоваться не константой Кд, а так называемым показателем константы диссоциации рК, который определяется соотношением
рК = – lg Кд.
Очевидно, что с возрастанием Кд, т.е. с увеличением силы кислоты, значение рК уменьшается; следовательно, чем больше рК, тем слабее кислота.
Степень диссоциации электролита α связана с изотоническим коэффициентом i соотношением:
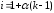 или
или
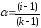 ;
;
здесь k – число ионов, на которые распадается при диссоциации молекула электролита (для КСl = 2, для ВаСl2 и Nа2SО4 k=3 и т.д.).
Таким образом, найдя по опытным величинам ∆р, ∆tзам и т.п. значение i, можно вычислить степень диссоциации электролита в данном растворе. При этом следует иметь в виду, что в случае сильных электролитов найденное таким способом значение α выражает лишь «кажущуюся» степень диссоциации, поскольку в растворах сильные электролиты диссоциированы полностью. Наблюдаемое отличие кажущейся степени диссоциации от единицы связано с межионными взаимодействиями в растворах сильных электролитов.
Теория сильных электролитов.
В водных растворах
сильные электролиты полностью
диссоциируют, поэтому число ионов в них
больше, чем в растворах слабых электролитов
той же концентрации. И если в растворах
слабых электролитов концентрация ионов
мала, расстояние между ними велико и
взаимодействие между ионами незначительно,
то в не очень разбавленных растворах
сильных электролитов среднее расстояние
между ионами вследствие значительной
концентрации сравнительно мало. Между
ними возникает электростатическое
взаимодействие, которое приводит к
тому, что катионы и анионы испытывают
взаимное притяжение, а ионы одного знака
заряда отталкиваются друг от друга.
Благодаря притяжению каждый ион как бы
окружен шарообразным роем противоположно
заряженных ионов, получившим название
«ионной атмосферы», в то время как ионы
одноименного знака располагаются дальше
(рис. 8.7). При этом ионы сольватируются
(гидратируются), что также отражается
на их свойствах и свойствах растворителя.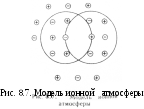
Впервые понятие «ионная атмосфера» предложено Дебаем и Хюккелем. Ионные атмосферы обладают следующими характерными особенностями:
в их состав входят катионы и анионы, однако преобладают ионы, противоположные по знаку заряду центрального иона;
cуммарный заряд ионной атмосферы равен по величине заряду центрального иона и противоположен ему по знаку;
все ионы в растворе равноправны, поэтому каждый из них является центральным ионом и одновременно входит в состав ионной атмосферы другого иона;
за счет теплового движения ионы, входящие в состав ионной атмосферы, постоянно меняются местами с ионами, находящимися за ее пределами, т.е. ионная атмосфера носит динамический характер.
Межионные силы влияют на все свойства растворов (электрическая проводимость, tкип и tзам, давление насыщенного пара, осмотическое давление). Так, в отсутствие внешнего электрического поля ионная атмосфера симметрична и силы, действующие на центральный ион, взаимно уравновешиваются. Если же приложить к раствору постоянное электрическое поле, то разноименно заряженные ионы будут перемещаться в противоположных направлениях. При этом каждый ион стремится двигаться в одну сторону, а окружающая его ионная атмосфера – в противоположную, вследствие чего направленное перемещение иона замедляется, а следовательно, уменьшается число ионов, проходящих через раствор в единицу времени, т.е. уменьшается сила тока. Чем больше концентрация раствора, тем сильнее проявляется тормозящее действие ионной атмосферы на электрическую проводимость раствора. Следовательно, в результате межионных взаимодействий все свойства раствора электролита, зависящие от концентрации ионов, проявляются так, как если бы число ионов в растворе было меньше, чем это соответствует полной диссоциации электролита.
Для оценки состояния ионов в растворе пользуются величиной, называемой активностью. Под активностью иона понимают ту эффективную, условную концентрацию его, соответственно которой он действует при химических реакциях. Активность иона a равна его истинной концентрации С, умноженной на коэффициент активности иона f:
![]() .
.
Коэффициент активности иона f - безразмерная величина, характеризующая степень отклонения свойств данного раствора от свойств идеального раствора:
![]() .
.
Коэффициенты активности зависят от природы растворителя и растворенного вещества, от заряда и природы иона, от концентрации раствора, от температуры.
В разбавленных растворах (С ≤ 0,5 моль/л) природа иона слабо сказывается на значении его коэффициента активности f. Приближенно можно считать, что в разбавленных растворах коэффициент активности иона f в данном растворителе практически не зависит от природы иона, зависит только от заряда иона и ионной силы раствора I, которая равна полусумме произведений концентрации С каждого иона на квадрат его заряда z:
![]() .
.
В химических справочниках значения f ионов в разбавленных растворах приводятся в зависимости от их зарядов z и ионной силы раствора I. Приближенно коэффициент активности иона в разбавленном растворе можно вычислить по формуле
![]() .
.
Активность и коэффициент активности можно определить на основании экспериментальных данных (по повышению tкип, понижению tзам, по давлению насыщенного пара над растворами и т.д.).
Подстановка величины активности (а) вместо концентрации (С) в уравнение закона действующих масс делает его справедливым при любых концентрациях.
Так, для обратимого процесса
КА К+ + А–,
отражающего диссоциацию слабого электролита в растворе, константа равновесия будет равна
![]() (термодинамическая
константа диссоциации).
(термодинамическая
константа диссоциации).
Для предельно разбавленных растворов (близких к идеальным), где отсутствуют силы взаимодействия ионов между собой из-за их отдаленности друг от друга, f= 1, т.е. = С. При обсуждении последующего материала примем, что концентрации разбавленных растворов электролитов существенно не отличаются от их активностей.
Электролитическая диссоциация кислот, оснований и солей в воде. Молекулы кислот в воде диссоциируют на ионы водорода (гидроксония-гидратированный ион водорода) и на анионы кислотного остатка. Например, уравнение диссоциации азотной кислоты имеет вид
HNO3+H2O = H3O+ + NO3ˉ
или при упрощенной записи
НNО3 = Н+ + NО3ˉ.
Максимальное число ионов водорода, образующихся из одной молекулы кислоты, определяет ее основность, следовательно НNО3 - одноосновная кислота.
У сильных кислот, диссоциирующих нацело, свойства кислот проявляются в большей степени, у слабых – в меньшей. Чем лучше кислота диссоциирует, т.е. чем больше ее константа диссоциации, тем она сильнее. Например, азотная кислота более сильная, чем йодноватая, т.к. Кд (HNO3) = 4,36*10 > Кд(HIO3) = 1,7*10-1.
Многоосновные кислоты диссоциируют ступенчато, последовательно отщепляя один ион водорода за другим, и каждая ступень ионизации характеризуется определенной константой диссоциации. Если кислота слабая, то на всех ступенях процесс обратимый. Так, для ортофосфорной кислоты:
1.
Н3РО4
Н+
+ Н2РО4ˉ

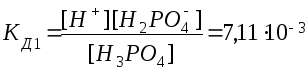 .
.
2.
Н2РО4ˉ
Н+
+ НРО42-
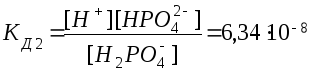 .
.
3. НРО42-
Н+
+ РО43-
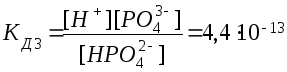 .
.
Из сопоставления приведенных выше значений констант диссоциации следует, что Кд1 > Кд2 > Кд3. Первый ион водорода отрывается от молекулы легче, последующие все труднее, т.к. возрастает отрицательный заряд кислотного остатка; поэтому в не очень разбавленных растворах фосфорной кислоты ионов РО43- мало. Неравенства Кд1 > Кд2 > …Кдn характерны и для других многоосновных кислот. Ориентировочно можно считать, что каждая последующая константа диссоциации меньше предыдущей в 105 раз. Они связаны между собой соотношением: КД= КД1* КД2*…*КДn.
Многоосновные сильные кислоты диссоциируют по первой ступени как сильные электролиты, а по второй – как электролиты средней силы, например:
Н2SО4 = Н+ + НSО4ˉ КД1=1*103,
НSО4- Н+ + SО42- КД2=2*10-2.
Способность многоосновных кислот диссоциировать ступенчато объясняет их склонность к образованию кислых солей.
Сила кислородсодержащих кислот зависит от строения молекулы. Формулу кислородсодержащих кислот в общем виде можно записать ЭОm(OH)n, имея в виду, что в их молекулах имеются связи Н-О-Э и Э=О. Как показывают исследования, сила кислот практически не зависит от n (числа ОН-групп), но заметно возрастает с увеличением m (числа несвязанных в ОН-группы атомов кислорода, т.е. со связями Э=О). По первой ступени ионизации кислоты типа Э(ОН)n относятся к очень слабым (Кд1 = 10-8 – 10-11, рКд1=7-11), типа ЭО(ОН)n – к слабым (Кд1=10-2-10-4, рКд1=1,5-4), типа ЭО2(ОН)n – к сильным и типа ЭО3(ОН)n – к очень сильным (табл.8.2).
Таблица 8.2
Классификация кислородсодержащих кислот по их силе в водных растворах*
|
Тип кислоты |
Кислота |
КД |
рКД |
Сила кислот |
|
Э(ОН)n |
HBrO |
2,06*10-9 |
8,7 |
Очень |
|
|
HClO |
3,2*10-8 |
7,5 |
слабые |
|
|
HIO |
2,3*10-11 |
10,64 |
|
|
|
H3AsO3 |
6*10-10 |
9,2 |
|
|
|
H3BO3 |
5,8*10-10 |
9,24 |
|
|
|
H4SiO4 |
2*10-10 |
9,7 |
|
|
|
H6TeO6 |
2*10-8 |
7,7 |
|
|
ЭО(ОН)n |
HClO2 |
1,1*10-2 |
1,97 |
Слабые |
|
|
HNO2 |
5,7*10-4 |
3,29 |
|
|
|
H2CO3 |
1,32*10-4 |
3,88 |
|
|
|
H2SO3 |
1,3*10-2 |
1,87 |
|
|
|
H3AsO4 |
6,46*10-3 |
2,19 |
|
|
|
H3РO4 |
7,25*10-3 |
2,12 |
|
|
|
H5IO6 |
3,1*10-2 |
1,57 |
|
|
ЭО2(ОН)n |
HBrO3 |
2*10-1 |
0,7 |
Сильные |
|
|
HClO3 |
|
-1 |
|
|
|
HIO3 |
1,7*10-1 |
0,77 |
|
|
|
HNO3 |
4,36*10 |
1,64 |
|
|
|
H2MnO4 |
10-1 |
- 1 |
|
|
|
H2SO4 |
1*103 |
-3 |
|
|
ЭО3(ОН)n |
HClO4 |
|
-10 |
Очень |
|
|
HMnO4 |
1*103 |
2,3 |
сильные |
Примечание: *В таблице приведены значения КДпервой ступени ионизации кислот.
Резкое возрастание силы в ряду кислот с увеличением m можно объяснить оттягиванием электронной плотности от связи Н-О на связь Э=О.
С увеличением степени окисления центрального атома Э изменение состава образуемых им кислородсодержащих кислот отвечает увеличению m, например:
|
Кислота |
+1 HClO |
+3 HClO2 |
+5 HClO3 |
+7 HClO4 |
|
Тип кислоты |
Cl(OH) |
ClO(OH) |
ClO2(OH) |
ClO3(OH) |
|
рКд |
7,25 |
1,97 |
-1 |
-5 |
В этом проявляется общая закономерность: с увеличением степени окисления элемента в ряду его гидроксидов основные свойства ослабевают, кислотные – усиливаются, например:
|
Соединение |
+2 Mn(OH)2 |
+3 Mn(OH)3 |
+4 Mn(OH)4 |
+6 H2MnO4 |
+7 HMnO4 |
|
H4MnO4 | |||||
|
Кислотно-основные свойства |
Основание средней силы |
Основание слабое |
А мфотерное соединение |
Кислота сильная |
Кислота очень сильная |
Молекулы оснований в воде диссоциируют на катионы металлов (исключение - NН4ОН NН4+ + ОН ˉ) и гидроксид- ионы. Например, уравнение диссоциации гидроксида натрия имеет вид
NаОН = Nа+ + ОНˉ.
Максимальное число гидроксид-ионов, образующихся из одной молекулы основания, определяет его кислотность, следовательно, NaOH – однокислотное основание.
Чем больше константа диссоциации основания, тем оно сильнее. Например, гидроксид лития более сильное основание, чем гидроксид аммония, т.к. Кд(LiOH) = 6,75*10-1 > Кд (NH4OH) = 1,8*10-5.
Многокислотные основания диссоциируют ступенчато, последовательно отщепляя один гидроксид – ион за другим, и каждая ступень ионизации характеризуется определенной константой диссоциации. Если основание слабое, то на всех ступенях процесс протекает обратимо, например:
Fе(ОН)3 Fе(ОН)2+ + ОНˉ ,
Fе(ОН)2+ Fе(ОН)2+ + ОНˉ ,
Fе(ОН)2+ Fе3+ + ОНˉ .
Многокислотные сильные основания диссоциируют по первой ступени как сильные электролиты, а по второй – как электролиты средней силы, например:
Са(ОН)2 = СаОН+ + ОНˉ,
СаОН+ Са2+ + ОНˉ.
Этим объясняется способность оснований многовалентных металлов образовывать основные соли, например Zn(ОН)Сl, Fе(ОН)Сl2 и др.
Гидроксиды многих металлов в водных растворах могут диссоциировать и по кислотному, и по основному типу. Соединения, которые в зависимости от условий проявляют как кислотные, так и основные свойства, называются амфотерными или амфолитами. Амфотерность электролитов объясняется малым различием прочности связей Э-О и О-Н. К амфотерным электролитам относятся : Zn(ОН)2, Al(ОН)3, Be(ОН)2, Ga(ОН)3, Cr(ОН)3, Ge(ОН)2, Sn(ОН)4, Pb(ОН)2 и др. Примером может служить диссоциация гидроксида цинка:
2H+ +[Zn(OH)4]2ˉ Zn(OH)2 +2H2O [Zn(H2O)2]2+ +2OHˉ.
При этом в кислой среде равновесие сдвигается вправо, в щелочной – влево. При взаимодействии гидроксида цинка, например, с азотной кислотой образуется нитрат цинка:
Zn(OH)2 + 2HNO3 Zn(NO3)2 + 2H2O;
при взаимодействии же с гидроксидом калия – тетрагидроксоцинкат калия:
Zn(OH)2 + 2KOH K2[Zn(OH)4].
Соли при электролитической диссоциации образуют катионы металлов (исключение соли аммония) или комплексные катионы и одноатомные или многоатомные анионы. Соли бывают средние (нейтральные, например, СаSО4), кислые (СаНРО4), основные (Zn(ОН)Сl), комплексные (K2[Zn(OH)4]).
Средние соли диссоциируют в одну стадию. Например,
Nа2SО4
= 2Nа+
+ SО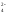 .
.
В кислых солях отщепляется сначала ион металла по типу сильного электролита, затем – ионы водорода по типу слабого электролита.
Например:
NаН2РО4
= Nа+
+ Н2РО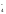 ,
,
Н2РО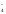 D
Н+
+ НРО
D
Н+
+ НРО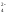 ,
,
НРО D
Н+
+ РО
D
Н+
+ РО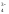 .
.
В последних двух ступенях равновесие сдвинуто влево, поэтому ионов Н+ в растворе очень мало.
В основных солях сначала отщепляется кислотный остаток по типу сильного электролита, затем - гидроксид–ионы по типу слабого электролита. Например,
(ZnОН)2SО4
= 2ZnОН+
+ SО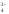 ,
,
ZnОН+ Zn2+ + ОНˉ.
В последней стадии равновесие сдвинуто влево, поэтому ионов ОНˉ в растворе мало.
Обменные реакции в растворах электролитов. В растворах электролитов реагирующими частицами являются ионы (точнее сольватированные или гидратированные ионы). Реакции, осуществляющиеся в результате обмена ионами между электролитами, называются ионообменными (или реакциями ионного обмена). Отличительной чертой реакций ионного обмена (РИО) является сохранение элементами их степеней окисления (реакции протекают без изменения заряда простых и сложных ионов).
Различают обратимые и необратимые РИО. Все реакции между ионами обратимы, протекают очень быстро. Однако в некоторых случаях равновесие сильно смещено в сторону образования продуктов реакции из-за удаления их из сферы реакции (т.е. реакции практически идут до конца, необратимы). РИО протекают практически необратимо, если исходные компоненты – сильные электролиты и растворимые вещества, а в ходе реакции образуются:
осадки (нерастворимые или малорастворимые);
газообразные вещества;
слабые электролиты (малодиссоциирующие вещества);
комплексные соединения.
В уравнениях необратимых РИО принято ставить знак « = ».
Закономерности, характерные для обратимых ионнообменных реакций:
1. Реакция ионного обмена обратима (может протекать в двух направлениях), если среди исходных и образующихся веществ есть слабые электролиты, нерастворимые, малорастворимые или газообразные вещества или если и исходные, и образующиеся вещества являются растворимыми и сильными электролитами. В уравнениях таких реакций ставят знак обратимости «».
2. Равновесие такой реакции смещается в направлении наиболее полного связывания ионов (их наименьшей концентрации в растворе).
Реакции обмена, написанные в молекулярной форме, не отражают особенностей взаимодействия между ионами в растворе. Сущность взаимодействия в растворах электролитов отражают ионно-молекулярные уравнения – полные и краткие. При составлении ионно-молекулярных уравнений:
1) сильные электролиты и одновременно растворимые вещества записывают в виде ионов;
2) слабые электролиты (малодиссоциирующие), нерастворимые, малорастворимые и газообразные вещества записывают в виде молекул с соответствующими значками: ↓ или ↑;
3) краткое ионно-молекулярное уравнение получают из полного путем исключения из него тех ионов, которые присутствуют в неизменном виде и количестве в правой и левой частях.
Примеры:
1. Молекулярное уравнение:
ВаСl2 + Nа2SО4 = ВаSО4↓ + 2NаСl.
Полное ионно-молекулярное уравнение:
Ва2+
+ 2Сl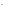 + 2Nа+
+ SО
+ 2Nа+
+ SО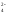 = ВаSО4↓
+ 2Nа+
+ 2Сl
= ВаSО4↓
+ 2Nа+
+ 2Сl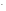 .
.
Сущность ионного процесса выражает краткое ионно-молекулярное уравнение:
Ва2+
+SО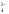 = ВаSО4↓.
= ВаSО4↓.
Поскольку ВаSО4 выпадает в осадок, который не участвует в обратной реакции, то и равновесие рассматриваемого процесса сильно смещено вправо, т.е. реакция практически идет до конца (∆G°= -60 кДж).
2.
Nа2СО3
+ Н2SО4
= Nа2SО4
+
![]() ,
,

2Nа+
+ СО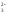 + 2Н+
+ SО
+ 2Н+
+ SО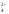 = 2Nа+
+ SО
= 2Nа+
+ SО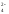 + Н2О
+ СО2↑,
+ Н2О
+ СО2↑,
СО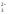 + 2Н+
= Н2СО3
= Н2О
+ СО2↑.
+ 2Н+
= Н2СО3
= Н2О
+ СО2↑.
В результате реакции получается газообразное вещество и слабый электролит.
3. 2КСN + Н2SО4 = 2НСN + К2SО4,
Н+
+СN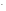 = НСN.
= НСN.
В результате реакции получается малодиссоциирующее соединение (слабый электролит) – НСN.
Обобщая этот пример, можно сделать вывод, что сильные кислоты вытесняют слабые из растворов их солей (аналогично сильные основания вытесняют слабые основания из растворов их солей).
К обменным ионным процессам относятся также реакции нейтрализации, в результате которых образуется слабый электролит – вода.
Например: НСl + КОН = Н2О + КСl,
Н+ + ОН ˉ = Н2О.
Реакции нейтрализации любых других сильных кислот и оснований протекают аналогично. Поскольку соль полностью диссоциирует на ионы, реакция в любом случае протекает лишь между ионами Н+ и ОН ˉ.
4. ZnСl2 + 4КОН = К2[Zn(ОН)4] + 2КCl,
Zn2+ + 4ОН‾ = [Zn(ОН)4]2‾.
В результате реакции образуется комплекс (комплексный ион).
5. НСN + СН3СООNа СН3СООН + NаСN,

НСN + СН3СОО‾ СН3СООН + СN‾.
NН4ОН
+ НСl
Н2О
+ NН4Сl,

NН4ОН + Н+ Н2О + NН4+.

Слабые электролиты есть и в левой, и в правой частях уравнений реакций. Равновесие обратимого процесса в этих случаях смещается в сторону образования вещества, обладающего меньшей константой диссоциации. В первой реакции равновесие смещено влево (КНСN = 4,9·10‾10, КСН3СООН = 1,8·10‾5), во второй – вправо (КН2О = 1,8·10‾16, КNН4ОН = 1,8·10‾5). Это отвечает значениям ∆G° = 43 кДж и (-84 кДж), соответственно, для первой и второй реакций.
Электролитическая диссоциация воды. Водородный показатель. Изучение тщательно очищенной от посторонних примесей воды показало, что она обладает определенной, хотя и незначительной электрической проводимостью, заметно возрастающей с повышением температуры. Так, при 273К удельная электрическая проводимость воды составляет 1,5·10-8 Ом-1·см-1, при 289К – 6,2·10-8 Ом-1·см-1.
Наличие электрической проводимости может быть объяснено только тем, что молекулы воды, хотя и в незначительной степени, распадаются на ионы, т.е. вода является слабым электролитом.
Процесс диссоциации воды может быть записан с учетом электростатического взаимодействия полярных молекул (самоионизации), в ходе которого образуются ионы гидроксония и гидроксид-ионы:
2Н2О Н3О+ + ОН‾
или в упрощенной форме: Н2О Н+ + ОН‾.
Выражение для константы электролитической диссоциации воды:
![]() (при
25°С).
(при
25°С).
Ничтожно малая диссоциация воды позволяет считать концентрацию недиссоциированных молекул равной общей концентрации, которая для воды объемом 1л. составляет:
![]() .
.
Найдем из выражения для Кд произведение двух постоянных при данной температуре величин:
Кд·[Н2О] = [Н+][ОН‾] = 1,8·10-16·55,6=10-14.
Произведение [Н+][ОН‾] называется ионным произведением воды (обозначается: КВ или Kw): КВ=[Н+][ОН‾]. Это величина постоянная при данной температуре.
Так при 25°С, ионное произведение воды КВ = [Н+][ОН‾] = 10-14.
Таким образом, для воды, разбавленных водных растворов кислот, щелочей, солей и др. соединений ионное произведение воды практически постоянная величина и зависит только от температуры:
|
Температура, 0С |
0 |
25 |
100 |
|
КB |
0,113·10-14 |
10-14 |
55·10-14 |
Растворы, в которых концентрация ионов водорода равна концентрации гидроксид-ионов, называют нейтральными. В чистой воде и нейтральных растворах при 25°С [Н+] = [ОН‾] = 10-7 моль/л. Если [Н+] > 10-7 моль/л, то среда кислая; если [Н+] < 10-7 моль/л, то среда щелочная.
Для удобства количественной характеристики кислотных или щелочных свойств растворов введена величина, называемая водородным показателем (рН) – это отрицательный десятичный логарифм концентрации ионов Н+:
рН = –lg[Н+].
В нейтральной среде [Н+]=10-7 моль/л, рН= – lg10-7 = 7;
в кислой среде рН < ;
в щелочной среде рН > 7.
Аналогично введен гидроксильный показатель (рОН) – это отрицательный десятичный логарифм концентрации гидроксид-ионов:
рОН= – lg[ОН¯].
Прологарифмируем с обратным знаком выражение для КВ при 25°С, используем введенные показатели рН и рОН и получим рН + рОН = 14.
Понятие об индикаторах. Индикаторы – вещества, меняющие свою окраску в определенной области значений рН раствора.
Индикаторами могут быть слабые органические кислоты HInd и основания IndOH, молекулы и ионы которых имеют разную окраску. Будучи введенными в исследуемый раствор, индикаторы диссоциируют по одному из следующих механизмов:
HInd H+ + Ind¯ (а)
IndOH Ind+ + OH¯ (б).
Так как процесс диссоциации слабых электролитов обратим, положение равновесия в схемах (а) и (б) зависит от кислотности исследуемого раствора.
В кислых растворах индикаторы, представляющие собой слабые кислоты, в соответствии с принципом Ле-Шателье находятся преимущественно в виде молекул и окраска раствора соответствует молекулярной форме индикатора НInd.
Индикаторы, являющиеся слабыми основаниями, в растворах кислот, напротив, будут находиться в своей ионной форме Ind+, которая обусловливает окраску раствора.
К числу индикаторов, представляющих собой слабые органические кислоты, принадлежат лакмус, фенолфталеин, феноловый красный, ализариновый желтый. К индикаторам, представляющим слабые основания, относятся, например, метиловый оранжевый, метиловый красный. Выбор того или иного индикатора определяется интервалом рН, в котором необходимо поддерживать кислотность исследуемого раствора.
Например, лакмус
НInd H+ + Ind¯
красный синий
рН < 6 рН > 8
рН = 6÷8 область перехода рН (фиолетовый цвет).
Гетерогенное равновесие. Произведение растворимости. Подавляющее большинство веществ обладает ограниченной растворимостью в воде и других растворителях. Поэтому на практике часто приходится встречаться с системами, в которых в состоянии равновесия находятся осадок и насыщенный раствор электролита. Вследствие динамического характера равновесия скорость процесса растворения осадка будет совпадать со скоростью обратного процесса кристаллизации.
Например, возьмем насыщенный раствор нерастворимого сильного электролита ВаSО4. В растворе устанавливается гетерогенное равновесие между осадком (твердой фазой) электролита и ионами электролита в растворе:
![]() .
.
Его можно охарактеризовать с точки зрения закона действующих масс, записав выражение для константы гетерогенного равновесия К:
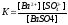 .
.
Преобразуем это выражение к виду: К[ВаSО4] = [Ва2+][SО42‾]; [ВаSО4] = const, как для твердого вещества, то К[ВаSО4] = const при данной температуре. Отсюда следует, что произведение концентраций ионов Ва2+ и SО42‾ также представляет собой постоянную величину. Это произведение называется произведением растворимости ПР:
ПР (BaSO4) = [Ва2+][SO42‾].
В общем виде для насыщенного раствора малорастворимого или нерастворимого сильного электролита АnBm, находящегося в равновесии с его твердой фазой, будет характерен следующий обратимый процесс:
![]() ,
,
для которого
ПР (AnBm) = [Аm+]n [Вn-]m.
Таким образом, гетерогенное равновесие «осадок – насыщенный раствор» подчиняется правилу произведения растворимости: произведение концентраций ионов электролита, содержащихся в его насыщенном растворе, возведенных в степени, соответствующие стехиометрическим коэффициентам, есть величина постоянная при данной температуре и называется произведением растворимости (ПР).
Из понятия ПР вытекают три следствия:
1. Условие образования осадка.
При увеличении концентрации одного из ионов электролита в его насыщенном растворе (например, путем введения другого электролита, содержащего тот же ион) произведение концентраций ионов становится больше ПР. При этом равновесие смещается в сторону образования осадка.
Осадок образуется, если произведение концентраций ионов, возведенных в степень стехиометрических коэффициентов, больше величины произведения растворимости: [Аm+]n·[Вn-]m > ПР(AnBm).
В результате образования осадка концентрация другого иона, входящего в состав электролита, тоже изменяется. Устанавливается новое равновесие, при котором произведение концентрации ионов электролита вновь становится равным ПР.
2. Условие растворения осадка.
Напротив, если в насыщенном растворе электролита уменьшить концентрацию одного из ионов (например, связав его каким-либо другим ионом), произведение концентраций ионов будет меньше значения ПР, раствор становится ненасыщенным, а равновесие между жидкой фазой и осадком сместится в сторону растворения осадка.
Осадок растворяется, если произведение концентраций ионов, возведенных в степень стехиометрических коэффициентов, меньше величины произведения растворимости: [Аm+]n·[Вn-]m < ПР (AnBm).
3. Условие получения одного малорастворимого соединения (II) из другого малорастворимого соединения (I): ПРII < ПРI. Например, химическое равновесие приведенной ниже реакции будет смещено вправо, в сторону образования AgI, т.к. ПР(AgI) = 1,5·10‾16 < ПР(AgCl) = 1,56·10‾10:
АgCl↓
+ NaI
AgI↓ + NaCl
AgCl↓ + I‾ AgI↓ + Cl‾.
Произведение
растворимости характеризует растворимость
вещества: чем больше ПР, тем больше
растворимость. ПР – табличная величина.

Исходя из значений ПР, можно выразить растворимость малорастворимых сильных электролитов в воде и растворах, содержащих другие электролиты.
Пример.
Произведение растворимости йодида свинца (II) при 20°С равно 8·10‾9. Вычислите растворимость соли (в моль/л) при указанной температуре.
|
t=20°С ПР(PbI2)= 8·10‾9 |
Решение. Уравнение электролитической диссоциации растворенной соли (сильного электролита): PbI2 = Pb2+ + 2I‾. Уравнение гетерогенного равновесия в растворе: PbI2 (тв)↓ Pb2+(р) + 2I‾(р). Обозначим искомую растворимость PbI2 через s (моль/л): s = С (PbI2). |
|
S-? |
Концентрация растворившейся соли PbI2 в насыщенном растворе составляет s; за счет диссоциации данного сильного электролита в соответствии со стехиометрическими соотношениями в растворе содержится s моль/л ионов Pb2+ и 2s моль/л ионов I‾, т.е. [Pb2+] = s; [I‾] = 2s.
Согласно правилу произведения растворимости и с учетом приведенных соотношений:
![]() ,
,
![]() моль/л.
моль/л.
Ответ: S = 1,3*10-3 моль/л.
