- •Министерство образования и науки российской федерации
- •«Тюменский государственный нефтегазовый университет» г.К.Севастьянова, т.М.Карнаухова Общая химия
- •Оглавление
- •1.2. Основные понятия химии
- •1.3. Основные законы химии
- •2. Современная теория строения атома. Периодический закон и система элементов д.И. Менделеева
- •2.1. Общие положения
- •2.2. Развитие представлений о строении атома
- •2.3. Квантово – механическая модель атома водорода. Исходные представления квантовой механики
- •2.4. Модель состояния электрона в атоме
- •2.5. Квантовые числа
- •2.6. Электронные конфигурации (формулы) элементов
- •2.7. Порядок заполнения электронами уровней, подуровней, орбиталей в многоэлектронных атомах
- •2.8. Электронные семейства элементов
- •2.9. Понятие об электронных аналогах
- •2.10. Периодический закон и периодическая система элементов д.И. Менделеева
- •2.11. Структура периодической системы химических элементов д. И. Менделеева
- •2.12. Периодическая система д.И. Менделеева и электронная структура атомов
- •2.13. Периодичность свойств элементов
- •3.Химическая связь и строение молекул
- •3.1. Основные понятия и определения
- •3.2. Теория метода валентных связей
- •3.3. Ковалентная связь
- •3.4. Насыщаемость ковалентной связи
- •3.5. Направленность ковалентной связи
- •3.6. Полярность и поляризуемость химической связи
- •3.7. Полярность молекул (типы ковалентных молекул)
- •3.8. Алгоритм выполнения заданий по теме «Химическая связь. Строение молекул»
- •3.8. Ионная связь
- •3.9. Металлическая связь
- •4. Основные классы неорганических соединений
- •4.1. Классификация веществ
- •4.2. Оксиды
- •4.3. Гидроксиды
- •4.4. Кислоты
- •4.5. Основания
- •4.6. Соли
- •5. Энергетика и направленность химических процессов (элементы химической термодинамики)
- •5.1 Основные понятия и определения
- •5.2. Первый закон термодинамики
- •5.3. Тепловой эффект химической реакции. Термохимия. Закон Гесса
- •5.4. Энтропия
- •5.5. Свободная энергия Гиббса
- •5.6. Свободная энергия Гельмгольца
- •6. Химическая кинетика
- •6.1. Основные понятия химической кинетики
- •6.2. Влияние природы реагирующих веществ
- •6.3. Закон действующих масс
- •6.4. Зависимость скорости химической реакции от температуры
- •6.5. Влияние катализатора
- •7. Химическое равновесие
- •7.1. Общие представления о химическом равновесии. Константа химического равновесия
- •7.2. Смещение химического равновесия. Принцип Ле Шателье
- •7.3. Фазовые равновесия. Правило фаз Гиббса
- •8. Дисперсные системы. Растворы
- •8.1. Дисперсные системы и их классификация
- •8.2. Общая характеристика растворов
- •8.3. Способы выражения концентрации растворов
- •8.4. Растворимость
- •8.5. Природа жидких растворов
- •8.6. Типы и свойства растворов
- •8.7. Свойства растворов неэлектролитов
- •8.8. Растворы электролитов
- •2. Температура.
- •3. Концентрация раствора.
- •4. Наличие одноименных ионов.
- •8.9. Равновесия и обменные реакции в растворах электролитов
- •8.10. Гидролиз солей
- •8.11. Комплексные соединения
- •9. Окислительно-восстановительные реакции
- •9.1. Общие понятия и определения
- •1. Метод электронного баланса.
- •2. Метод ионно-электронный (метод полуреакций; метод ионно-электронного баланса).
- •9.2. Восстановители и окислители
- •Важнейшие восстановители и окислители
- •9.3. Влияние среды на окислительно-восстановительные реакции
- •Кислая среда (рн 7)
- •9.4. Типы окислительно-восстановительных реакций
- •9.5. Окислительно – восстановительные (электродные) потенциалы
- •9.6. Направление протекания окислительно-восстановительных реакций
- •10. Электрохимические процессы
- •10.1. Гальванические элементы (химические источники электрического тока)
- •10.2. Электролиз
- •10.3. Коррозия металлов
- •10.4. Защита металлов от коррозии
- •11. Свойства металлов
- •11.1. Физические свойства металлов
- •11.2. Химические свойства металлов
- •Очень разб.
- •Литература
- •Приложение 1 Электронные конфигурации элементов
- •625000, Г. Тюмень, ул. Володарского, 38
- •625039, Г. Тюмень, ул. Киевская, 52
2.12. Периодическая система д.И. Менделеева и электронная структура атомов
Рассмотрим связь между положением элемента в периодической системе и электронным строением его атомов. У каждого последующего элемента периодической системы на один электрон больше, чем у предыдущего. Полные записи электронных конфигураций (формул) первых двух периодов приведены в табл. 2.2.
Таблица 2.2
Электронные конфигурации элементов первых двух периодов
|
Атомный номер |
Элемент |
Электронная конфигурация |
|
1 |
Водород |
1s1 |
|
2 |
Гелий |
1s2 |
|
3 |
Литий |
|
|
4 |
Бериллий |
|
|
5 |
Бор |
1s22s22p1 |
|
6 |
Углерод |
1s22s22p2 |
|
7 |
Азот |
1s22s22p3 |
|
8 |
Кислород |
1s22s22p4 |
|
9 |
Фтор |
1s22s22p5 |
|
10 |
Неон |
1s22s22p6 |
Первый период состоит из двух элементов: водорода и гелия (Z=2). Оба элемента являются s-элементами. Атомом гелия заканчивается формирование первого уровня (K-оболочки; n = 1) атома, обозначим её [He].
У элементов второго периода формируется второй энергетический уровень (L – оболочка; n = 2), заполняются s- и p- подуровни. Li (Z = 3) и Be (Z=4) относятся к s –элементам, остальные шесть элементов периода входят в число p-элементов. У элемента Ne (Z=10) полностью заполнен 2p –подуровень, обозначим его электронную конфигурацию как [Ne]. Электронные конфигурации элементов в основном состоянии в краткой записи представлены в приложении 1(запись электронной конфигурации полностью заполненных подуровней предыдущих периодов не приводится).
У
элементов 3-го периода заполняется
третий уровень (оболочка М; n=3),
состоящий из 3s-,
3p-
и 3d-орбиталей.
Начинается период с натрия (Z=11),электронная
конфигурация которого
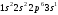 ,
и заканчивается аргоном (Z=18),
с электронной конфигурацией
,
и заканчивается аргоном (Z=18),
с электронной конфигурацией
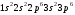 .
Натрий – аналог лития, аргон – неона.
В третьем периоде, так же, как и во втором,
восемь элементов, из них два первых
элементаNa(Z=11)
и Mg(Z=12)
являются s-элементами,
шесть последних (Al
- Ar)
– p-элементами.
.
Натрий – аналог лития, аргон – неона.
В третьем периоде, так же, как и во втором,
восемь элементов, из них два первых
элементаNa(Z=11)
и Mg(Z=12)
являются s-элементами,
шесть последних (Al
- Ar)
– p-элементами.
Хотя в третьем уровне (оболочка М) имеется подуровень 3d, который остается незаконченным, в четвертом периоде начинает формироваться следующий уровень- четвертый (оболочка N; n=4) и период начинается с s- элемента калия (Z=19).
Внешний
4s
- электрон придает элементу свойства,
сходные со свойствами натрия. Появление
электрона в 4s-состоянии
при наличии свободных 3d-орбиталей
обусловливается экранированием
(заслонением)
ядра плотным и симметричным электронным
слоем
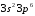 .
В связи с отталкиванием от этого слоя
для 19-го электрона атома калия и 20-го
электрона атома кальция энергетически
выгодным оказывается 4s-
состояние:
.
В связи с отталкиванием от этого слоя
для 19-го электрона атома калия и 20-го
электрона атома кальция энергетически
выгодным оказывается 4s-
состояние:
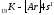 ,
,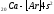 .
.
То
есть энергия 4s–подуровня
несколько ниже, чем энергия 3d–подуровня
(см. рис. 2.4). В соответствии с правилом
Клечковского, (n+ℓ)
у 4s(4)
ниже, чем (n+ℓ)
у 3d
(5). С элемента скандия (Z=21)
начинается заполнение 3d-подуровня,
так как он энергетически более выгоден,
чем 4p-подуровень.
Пять орбиталей 3d-подуровня
могут быть заняты десятью электронами,
что осуществляется у атомов от скандия
до цинка (Z=30).
Элементы от
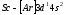 до
до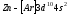 относятся
кd-элементам.
У d
- элементов 4-го периода, следовательно,
достраивается слой М (третий уровень;
n=3)
до 18 электронов. В связи с этим важно
отметить, что физические и химические
свойства элементов в первую очередь
определяются структурой внешнего
энергетического слоя их атомов и лишь
в меньшей степени зависят от строения
предшествующих (внутренних) электронных
слоёв. У атомов всех d-элементов
внешний слой образован одним, двумя
s-электронами,
поэтому химические свойства d-элементов
с увеличением порядкового номера
изменяются не так резко, как свойства
s-
и p-элементов.
Все d-элементы
принадлежат к металлам, тогда как
заполнение внешнего p-подуровня
приводит к переходу от металла к типичному
неметаллу и, наконец, к благородному
(инертному) газу.
относятся
кd-элементам.
У d
- элементов 4-го периода, следовательно,
достраивается слой М (третий уровень;
n=3)
до 18 электронов. В связи с этим важно
отметить, что физические и химические
свойства элементов в первую очередь
определяются структурой внешнего
энергетического слоя их атомов и лишь
в меньшей степени зависят от строения
предшествующих (внутренних) электронных
слоёв. У атомов всех d-элементов
внешний слой образован одним, двумя
s-электронами,
поэтому химические свойства d-элементов
с увеличением порядкового номера
изменяются не так резко, как свойства
s-
и p-элементов.
Все d-элементы
принадлежат к металлам, тогда как
заполнение внешнего p-подуровня
приводит к переходу от металла к типичному
неметаллу и, наконец, к благородному
(инертному) газу.
После
заполнения 3d-орбиталей
у последующих шести элементов (Ga-Kr)
заполняются p-орбитали
внешнего слоя. Четвертый период
завершается формированием подуровня
4р у криптона – [Ar]
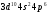 или [Kr],
являющегося аналогом аргона. Всего в
четвертом периоде 18 элементов. Таким
образом, четвертый период начинается
двумя s-элементами
и заканчивается шестью р-элементами,
но в отличие от второго и третьего
периодов между s-
и p-элементами
располагаются десять d-элементов
(вставная декада большого периода;
переходные элементы).
или [Kr],
являющегося аналогом аргона. Всего в
четвертом периоде 18 элементов. Таким
образом, четвертый период начинается
двумя s-элементами
и заканчивается шестью р-элементами,
но в отличие от второго и третьего
периодов между s-
и p-элементами
располагаются десять d-элементов
(вставная декада большого периода;
переходные элементы).
В
пятом периоде заполнение электронных
уровней и подуровней происходит, как и
в четвертом периоде, а именно: у двух
первых элементов (s-элементов
37Rb
и 38Sr)
и шести последних (р - элементов
 )
заполняется внешний слой. Междуs-
и р - элементами располагаются десять
d
– элементов (
)
заполняется внешний слой. Междуs-
и р - элементами располагаются десять
d
– элементов (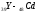 ),
у которых заполняютсяd
– орбитали предвнешнего уровня (4d
- подуровень). Всего в пятом периоде 18
элементов.
),
у которых заполняютсяd
– орбитали предвнешнего уровня (4d
- подуровень). Всего в пятом периоде 18
элементов.
Шестой
период содержит 32 элемента (см. приложение
1) и тоже начинается двумя s
– элементами ( и
и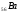 ).
Далее у лантана начинает заполнятьсяd
– орбиталь предвнешнего уровня (5d
- подуровень):
).
Далее у лантана начинает заполнятьсяd
– орбиталь предвнешнего уровня (5d
- подуровень):
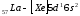 .
.
После
чего заполнение этого подуровня
приостанавливается, а начинает заполняться
энергетически более выгодный 4f
– подуровень (рис. 2.4), семь орбиталей
которого могут быть заняты 14 электронами.
Это происходит у 14 атомов элементов
лантаноидов
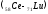 ,
относящихся кf
– элементам. Поскольку у этих элементов
заполняется глубинный 4f
– подуровень третьего снаружи уровня,
они обладают близкими химическими
свойствами. С гафния (Z=72)
возобновляется заполнение 5d
подуровня и заканчивается у ртути
(Z=80),
после чего электроны заполняют 6р –
подуровень: шестой период, как и пятый,
завершается шестью р – элементами
,
относящихся кf
– элементам. Поскольку у этих элементов
заполняется глубинный 4f
– подуровень третьего снаружи уровня,
они обладают близкими химическими
свойствами. С гафния (Z=72)
возобновляется заполнение 5d
подуровня и заканчивается у ртути
(Z=80),
после чего электроны заполняют 6р –
подуровень: шестой период, как и пятый,
завершается шестью р – элементами

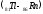 .
В шестом периоде 32 элемента, из них: дваs
– элемента, шесть р – элементов, десять
d
– элементов и четырнадцать f
– элементов.
.
В шестом периоде 32 элемента, из них: дваs
– элемента, шесть р – элементов, десять
d
– элементов и четырнадцать f
– элементов.
В
седьмом периоде имеются два s
– элемента
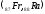 ,
за ними следуютd
– элемент
,
за ними следуютd
– элемент
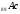 и четырнадцатьf
– элементов - актиноидов
и четырнадцатьf
– элементов - актиноидов
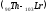 ,
далее сноваd
– элементы (
,
далее сноваd
– элементы (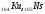 ,
элементы 106 - 110).Актиноиды, как и лантаноиды,
обладают многими сходными химическими
свойствами. В противоположность
предыдущим, 7-й период не завершён.
,
элементы 106 - 110).Актиноиды, как и лантаноиды,
обладают многими сходными химическими
свойствами. В противоположность
предыдущим, 7-й период не завершён.
Изложенное показывает, что по мере роста заряда ядра происходит закономерная периодическая повторяемость сходных электронных структур элементов, а следовательно, и повторяемость их свойств, зависящих от строения электронных оболочек атомов.
Периодическая система Д. И. Менделеева отражает периодический закон, является естественной классификацией химических элементов по электронной структуре их атомов.