
- •Северо-казахстанский
- •Лекция 1. Относительность движения. Закон движения, траектория, путь, перемещение. Векторы скорости и ускорения. Тангенциальное и нормальное ускорение
- •I. Механическое движение
- •III. Траектория, путь и перемещение
- •V. Координатный способ задания движения
- •II. Второй закон Ньютона.
- •III. Третий закон Ньютона.
- •IV. Момент импульса материальной точки, момент силы, момент инерции
- •Лекция 4 Работа силы и мощность. Кинетическая энергия. Консервативные и неконсервативные силы. Потенциальная энергия. Связь силы с потенциальной энергией.
- •II. Механическая мощность
- •III. Кинетическая и потенциальная энергии.
- •Лекция 5 Система материальных точек. Внешние и внутренние силы. Замкнутая система. Закон сохранения импульса. Закон сохранения механической энергии.
- •II. Закон сохранения импульса
- •III. Закон сохранения энергии
- •III Момент инерции и момент силы. Момент импульса системы, закон сохранения момента импульса замкнутой системы
- •Лекция 7 Оси вращения. Условие равновесия тела
- •II. Условия равновесия твёрдого тела. Виды равновесия
- •III. Теорема Гюйгенса-Штейнера
- •Лекция 8 Кинетическая энергия вращения твердого тела. Расчёт моментов инерции различных тел
- •II. Расчет моментов инерции различных тел
- •Лекция 9 Основные положения молекулярно-кинетической теории
- •I Масса и размеры молекул. Идеальный газ. Основное уравнение молекулярно-кинетической теории.
- •II Основные законы идеального газа.
- •III Уравнение состояния идеального газа.
- •IV Температура, как мера средней кинетической энергии.
- •Лекция 10 Распределение Максвелла и Больцмана
- •I Распределение Максвелла.
- •II Барометрическая формула. Распределение Больцмана.
- •III Экспериментальное определение числа Авагадро.
- •Лекция 11 Первое начало термодинамики
- •I Внутренняя энергия.
- •II Работа и теплопередача.
- •III Первое начало термодинамики.
- •IV Теплоемкость.
- •V Применение первого начала термодинамики к изопроцессам.
- •VI Адиабатический процесс. Политропный процесс.
- •Лекция 12 Второе начало термодинамики
- •II Энтропия.
- •III Различные формулировки второго начала термодинамики.
- •IV Цикл Карно.
- •Лекция 13 Процессы переноса
- •I Среднее число столкновений и средняя длина свободного пробега молекул.
- •II Явления переноса.
- •Лекция 14 Реальный газ
- •I Межмолекулярное взаимодействие.
- •II Уравнение Ван–дер-Ваальса.
- •III Изотермы Ван-дер-Ваальса.
- •Лекция 15 Жидкости. Твердые тела. Фазовые переходы
- •I Поверхностное натяжение, капиллярные явления.
- •II Твердые тела.
- •III Фазовые переходы
II Основные законы идеального газа.
Состояние данной массы газа характеризуют его параметры: объем V, давление р и температура Т. Законы, которые устанавливают взаимосвязь этих параметров при разных состояниях газа, называют газовыми законами. Процессы, протекающие при постоянстве одного из параметров, называют изопроцессами.
1). Закон Бойля - Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная: рV=const при Т=const, m=const (8). Процесс, протекающий при постоянной температуре, называется изотермическим. Кривая, изображающая зависимость между величинами p и V, характеризующими свойства вещества при постоянной температуре, называется изотермой. Изотерма, соответствующая меньшей температуре, находится ближе к осям координат. Графики изотермического процесса в различных координатах:

2). Закон Гей-Люссака: при постоянном давлении объем данной массы идеального газа прямо пропорционален его абсолютной температуре: V/T=const при p=const и m=const (9). Процесс, протекающий при постоянном давлении, называется изобарным. Изобара, соответствующая более высокому давлению, лежит ниже изобары, соответствующей меньшему давлению. Графики изобарного процесса в различных координатах:

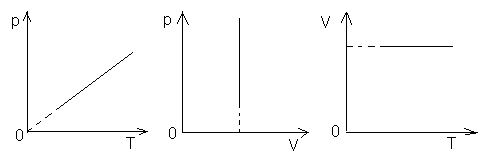
3). Закон Шарля: при постоянном объеме давление данной массы идеального газа прямо пропорционально его абсолютной температуре: р/Т=const при V=const и m=const (10). Процесс, протекающий при постоянном объеме, называется изохорным. Графики изохорного процесса в различных координатах:
4). Закон Авагадро: при одинаковых давлениях и температурах в равных объемах газа содержится одинаковое количество молекул.
Следствие: при нормальных условиях один моль любого газа занимает объем V=22,41 л (11).
Число молекул в 1 м3 при н.у. 2,7·1025 (12) – число Лошмидта
5). Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов, т.е. р=р1+р2+…+рn (13), где р1, р2,…рn – парциальные давления – давления, которые оказывали бы газы смеси, если бы они одни занимали объем, равный объему смеси при той же температуре.
6).
Объединенный
газовый закон (уравнение Клапейрона):
произведение давления данной массы
идеального газа на его объем, деленное
на абсолютную температуру, есть величина
постоянная:
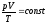 ,
приm=const
(14).
,
приm=const
(14).
III Уравнение состояния идеального газа.
Возьмем
1 моль идеального газа при н.у. (р=1,013·105
Па и Т=273 К). Согласно закону Авагадро
V=22,4
л=22,4·10-3
м3.
Подставим эти данные в (14). Тогда :
 ,R=8,31
Дж/(моль·К) (15) – универсальная
газовая постоянная.
Если имеется не один, а ν молей, то объем
газа будет в ν раз больше, т.е для какого-то
произвольного объема V
универсальная газовая постоянная R
увеличится в ν раз, т.е.
,R=8,31
Дж/(моль·К) (15) – универсальная
газовая постоянная.
Если имеется не один, а ν молей, то объем
газа будет в ν раз больше, т.е для какого-то
произвольного объема V
универсальная газовая постоянная R
увеличится в ν раз, т.е.
 . Учитывая, что
. Учитывая, что можно записать:
можно записать: (16)
–уравнение
состояния идеального газа (уравнение
Менделеева - Клапейрона).
(16)
–уравнение
состояния идеального газа (уравнение
Менделеева - Клапейрона).
IV Температура, как мера средней кинетической энергии.
Определим
соотношение между средней кинетической
энергией теплового движения молекул
<E>
идеального газа и его абсолютной
температурой Т. Согласно основному
уравнению МКТ идеального газа
 .
Из (16) выразим р, получим
.
Из (16) выразим р, получим .
Решив совместно систему из этих двух
уравнений, получим:
.
Решив совместно систему из этих двух
уравнений, получим: .
Т.к.R
и NA
- постоянные, то можно найти их отношение
.
Т.к.R
и NA
- постоянные, то можно найти их отношение
 .
Введем обозначение:k=1,38·10-23
Дж/К (17) – постоянная
Больцмана.
Подставив ее в уравнение для энергии
имеем:
.
Введем обозначение:k=1,38·10-23
Дж/К (17) – постоянная
Больцмана.
Подставив ее в уравнение для энергии
имеем:
 (18) –уравнение
Больцмана.
(18) –уравнение
Больцмана.
Физ.смысл абсолютной температуры: абсолютная температура есть количественная мера средней кинетической энергии теплового (поступательного) движения молекул.
Установим связь между р, n и Т, для этого подставим (18) в основное уравнение МКТ. р=nkT (19).
