
- •Северо-казахстанский
- •Лекция 1. Относительность движения. Закон движения, траектория, путь, перемещение. Векторы скорости и ускорения. Тангенциальное и нормальное ускорение
- •I. Механическое движение
- •III. Траектория, путь и перемещение
- •V. Координатный способ задания движения
- •II. Второй закон Ньютона.
- •III. Третий закон Ньютона.
- •IV. Момент импульса материальной точки, момент силы, момент инерции
- •Лекция 4 Работа силы и мощность. Кинетическая энергия. Консервативные и неконсервативные силы. Потенциальная энергия. Связь силы с потенциальной энергией.
- •II. Механическая мощность
- •III. Кинетическая и потенциальная энергии.
- •Лекция 5 Система материальных точек. Внешние и внутренние силы. Замкнутая система. Закон сохранения импульса. Закон сохранения механической энергии.
- •II. Закон сохранения импульса
- •III. Закон сохранения энергии
- •III Момент инерции и момент силы. Момент импульса системы, закон сохранения момента импульса замкнутой системы
- •Лекция 7 Оси вращения. Условие равновесия тела
- •II. Условия равновесия твёрдого тела. Виды равновесия
- •III. Теорема Гюйгенса-Штейнера
- •Лекция 8 Кинетическая энергия вращения твердого тела. Расчёт моментов инерции различных тел
- •II. Расчет моментов инерции различных тел
- •Лекция 9 Основные положения молекулярно-кинетической теории
- •I Масса и размеры молекул. Идеальный газ. Основное уравнение молекулярно-кинетической теории.
- •II Основные законы идеального газа.
- •III Уравнение состояния идеального газа.
- •IV Температура, как мера средней кинетической энергии.
- •Лекция 10 Распределение Максвелла и Больцмана
- •I Распределение Максвелла.
- •II Барометрическая формула. Распределение Больцмана.
- •III Экспериментальное определение числа Авагадро.
- •Лекция 11 Первое начало термодинамики
- •I Внутренняя энергия.
- •II Работа и теплопередача.
- •III Первое начало термодинамики.
- •IV Теплоемкость.
- •V Применение первого начала термодинамики к изопроцессам.
- •VI Адиабатический процесс. Политропный процесс.
- •Лекция 12 Второе начало термодинамики
- •II Энтропия.
- •III Различные формулировки второго начала термодинамики.
- •IV Цикл Карно.
- •Лекция 13 Процессы переноса
- •I Среднее число столкновений и средняя длина свободного пробега молекул.
- •II Явления переноса.
- •Лекция 14 Реальный газ
- •I Межмолекулярное взаимодействие.
- •II Уравнение Ван–дер-Ваальса.
- •III Изотермы Ван-дер-Ваальса.
- •Лекция 15 Жидкости. Твердые тела. Фазовые переходы
- •I Поверхностное натяжение, капиллярные явления.
- •II Твердые тела.
- •III Фазовые переходы
Лекция 14 Реальный газ
План лекции
Межмолекулярное взаимодействие
Уравнение Ван-дер-Ваальса
Изотермы Ван-дер-Ваальса
I Межмолекулярное взаимодействие.
Разряженные реальные газы при не слишком низких температурах с достаточной степенью точности подчиняются законам идеальных газов. Повышение давления приводит к уменьшению среднего расстояния между молекулами, поэтому необходимо учитывать объем молекул и взаимодействие между ними.
Реальные газы – газы, свойства которых зависят от взаимодействия молекул. При их рассмотрении необходимо учитывать силы межмолекулярного взаимодействия.
Атомы
и молекулы вещества – сложные системы
движущихся заряженных частиц, между
которыми действуют силы притяжения и
отталкивания электрического происхождения.
Эти силы короткодействующие. Они
становятся пренебрежимо малыми уже на
расстояниях порядка трех – четырех
диаметров молекулы, причем силы
отталкивания убывают с расстоянием
быстрее, чем силы притяжения. Рассмотрим
две молекулы 1 и 2. Проведем через центры
молекул ось r
в направлении от 1 молекулы ко 2 (рис.а).
Fпр<0,
Fот>0.
График зависимости сил от расстояний
между молекулами рас.б. График проекции
на ось r
результирующей силы Рис.а. Из графика
видно: 1) если r<ro
– преобладают силы отталкивания, 2) если
r>ro
– преобладают силы притяжения, 3) если
r=ro
– равны.
II Уравнение Ван–дер-Ваальса.
Чтобы получить уравнение состояния реального газа, необходимо внести в уравнение состояния идеального газа поправки, учитывающие силы межмолекулярного взаимодействия.
1)
Поправка на собственный объем молекул
(учет сил отталкивания). Так как молекулы
реальных газов нельзя считать материальными
точками, они сами занимают некоторый
объем и этот объем недоступен для их
движения. Учтем этот недоступный объем
в виде поправки b
(b
- объем, занимаемый самими молекулами),
тогда уравнение состояния для 1 моля
примет вид p(Vm
-b)=RT.
Для подсчета недоступного объема
предположим, что имеют место только
парные столкновения молекул. Сталкиваясь,
две молекулы сближаются на расстояние
d,
равное эффективному диаметру. Для
центров обеих молекул недоступным
является объем сферы радиуса d.
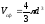 ,
а объем молекулы
,
а объем молекулы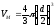 ,
тогда
,
тогда ,
т.е. для двух молекул недоступным будет
объем превышающий объем одной молекулы
в 8 раз. В расчете на одну молекулу,
недоступным оказывается объем, равный
учетверенному объему одной молекулы.
,
т.е. для двух молекул недоступным будет
объем превышающий объем одной молекулы
в 8 раз. В расчете на одну молекулу,
недоступным оказывается объем, равный
учетверенному объему одной молекулы.
2)
Поправка на внутреннее давление (учет
сил притяжения). Действие сил притяжения
газа приводит к появлению дополнительного
давления на газ, называемого внутренним
давлением. По вычислениям Ван-дер-Ваальса,
внутреннее давление обратно пропорционально
квадрату молярного объема
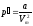 (1), где а – постоянная Ван-дер-Ваальса,
характеризующая силы межмолекулярного
притяжения,Vm
– молярный объем.
(1), где а – постоянная Ван-дер-Ваальса,
характеризующая силы межмолекулярного
притяжения,Vm
– молярный объем.
Вводя
эти поправки, получим уравнение
Ван-дер-Ваалься для моля газа – уравнение
состояния реальных газов.
 (2),
т.к.V=νVm=>Vm=V/ν,
тогда
(2),
т.к.V=νVm=>Vm=V/ν,
тогда
 (3),
где а иb
– постоянные для каждого газа величины,
определяемые опытным путем. Уравнение
Ван-дер-Ваальса более точно, чем уравнение
Менделеева – Клапейрона, но и оно
приближенное.
(3),
где а иb
– постоянные для каждого газа величины,
определяемые опытным путем. Уравнение
Ван-дер-Ваальса более точно, чем уравнение
Менделеева – Клапейрона, но и оно
приближенное.
