
- •Северо-казахстанский
- •Лекция 1. Относительность движения. Закон движения, траектория, путь, перемещение. Векторы скорости и ускорения. Тангенциальное и нормальное ускорение
- •I. Механическое движение
- •III. Траектория, путь и перемещение
- •V. Координатный способ задания движения
- •II. Второй закон Ньютона.
- •III. Третий закон Ньютона.
- •IV. Момент импульса материальной точки, момент силы, момент инерции
- •Лекция 4 Работа силы и мощность. Кинетическая энергия. Консервативные и неконсервативные силы. Потенциальная энергия. Связь силы с потенциальной энергией.
- •II. Механическая мощность
- •III. Кинетическая и потенциальная энергии.
- •Лекция 5 Система материальных точек. Внешние и внутренние силы. Замкнутая система. Закон сохранения импульса. Закон сохранения механической энергии.
- •II. Закон сохранения импульса
- •III. Закон сохранения энергии
- •III Момент инерции и момент силы. Момент импульса системы, закон сохранения момента импульса замкнутой системы
- •Лекция 7 Оси вращения. Условие равновесия тела
- •II. Условия равновесия твёрдого тела. Виды равновесия
- •III. Теорема Гюйгенса-Штейнера
- •Лекция 8 Кинетическая энергия вращения твердого тела. Расчёт моментов инерции различных тел
- •II. Расчет моментов инерции различных тел
- •Лекция 9 Основные положения молекулярно-кинетической теории
- •I Масса и размеры молекул. Идеальный газ. Основное уравнение молекулярно-кинетической теории.
- •II Основные законы идеального газа.
- •III Уравнение состояния идеального газа.
- •IV Температура, как мера средней кинетической энергии.
- •Лекция 10 Распределение Максвелла и Больцмана
- •I Распределение Максвелла.
- •II Барометрическая формула. Распределение Больцмана.
- •III Экспериментальное определение числа Авагадро.
- •Лекция 11 Первое начало термодинамики
- •I Внутренняя энергия.
- •II Работа и теплопередача.
- •III Первое начало термодинамики.
- •IV Теплоемкость.
- •V Применение первого начала термодинамики к изопроцессам.
- •VI Адиабатический процесс. Политропный процесс.
- •Лекция 12 Второе начало термодинамики
- •II Энтропия.
- •III Различные формулировки второго начала термодинамики.
- •IV Цикл Карно.
- •Лекция 13 Процессы переноса
- •I Среднее число столкновений и средняя длина свободного пробега молекул.
- •II Явления переноса.
- •Лекция 14 Реальный газ
- •I Межмолекулярное взаимодействие.
- •II Уравнение Ван–дер-Ваальса.
- •III Изотермы Ван-дер-Ваальса.
- •Лекция 15 Жидкости. Твердые тела. Фазовые переходы
- •I Поверхностное натяжение, капиллярные явления.
- •II Твердые тела.
- •III Фазовые переходы
VI Адиабатический процесс. Политропный процесс.
Адиабатическим
называется процесс, при котором
отсутствует теплообмен (δQ=0)
между системой и окружающей средой. К
адиабатическим процессам можно отнести
быстропротекающие процессы. Из I
начала термодинамики (δQ=dU+δA)
для адиабатического процесса следует,
что δА= - dU
(14),
т.е. внешняя работа совершается за счет
изменения внутренней энергии системы.
Перепишем (14) в виде
 (*)
Продифференцируем уравнение состояния
идеального газа
(*)
Продифференцируем уравнение состояния
идеального газа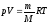 ,
получим
,
получим (**). Разделим (**) на (*)
(**). Разделим (**) на (*) .
Разделив переменные и учитывая, что
Ср/СV=γ,
найдем dp/p=
- γdV/V.
Интегрируя это уравнение в пределах от
р1
до р2
и соответственно от V1
до V2,
а затем потенцируя, получим
.
Разделив переменные и учитывая, что
Ср/СV=γ,
найдем dp/p=
- γdV/V.
Интегрируя это уравнение в пределах от
р1
до р2
и соответственно от V1
до V2,
а затем потенцируя, получим
 илиp1V1γ=p2V2γ.
Т.к. состояния 1 и 2 выбраны произвольно,
то можно записать pVγ=const
(15). – уравнение адиабатического процесса
(уравнение Пуассона). Используя уравнение
Менделеева – Клапейрона можно получить
TVγ-1=const
(16) и Tγp1-γ=const
(17). В этих уравнениях γ – называется
показателем адиабаты (или коэффициентом
Пуассона).
илиp1V1γ=p2V2γ.
Т.к. состояния 1 и 2 выбраны произвольно,
то можно записать pVγ=const
(15). – уравнение адиабатического процесса
(уравнение Пуассона). Используя уравнение
Менделеева – Клапейрона можно получить
TVγ-1=const
(16) и Tγp1-γ=const
(17). В этих уравнениях γ – называется
показателем адиабаты (или коэффициентом
Пуассона).
Диаграмма адиабатического процесса (адиабата) в координатах р, V изображается гиперболой, но адиабата более крута, чем изотерма. Это объясняется тем, что при адиабатном сжатии 1-3 увеличение давления газа обусловлено не только уменьшением его объема, как при изотермическом сжатии, но и повышением температуры.
Найдем
работу
 если газ адиабатически расширяется от
объемаV1
до V2,
то его температура уменьшается от Т1
до Т2
и работа расширения идеального газа
если газ адиабатически расширяется от
объемаV1
до V2,
то его температура уменьшается от Т1
до Т2
и работа расширения идеального газа
 (18). Из уравнения (16)
(18). Из уравнения (16) .
Заменим Т наV.
.
Заменим Т наV.
 (19). Работа, совершенная газом при
адиабатическом расширении 1-2 , меньше,
чем при изотермическом. При адиабатическом
расширении происходит охлаждение газа,
а при изотермическом температура
поддерживается постоянной за счет
притока извне эквивалентного количества
теплоты.
(19). Работа, совершенная газом при
адиабатическом расширении 1-2 , меньше,
чем при изотермическом. При адиабатическом
расширении происходит охлаждение газа,
а при изотермическом температура
поддерживается постоянной за счет
притока извне эквивалентного количества
теплоты.
Все
рассмотренные процессы протекают при
постоянной температуре. (При изотермическом
с= ,
т.к. С=Q/mdT,
а dT=0.
При адиабатном Q=0
и с=0.). Процесс, в котором теплоемкость
остается постоянной, называется
политропным.
Уравнение политропы pVn=const
где
,
т.к. С=Q/mdT,
а dT=0.
При адиабатном Q=0
и с=0.). Процесс, в котором теплоемкость
остается постоянной, называется
политропным.
Уравнение политропы pVn=const
где
 - показатель политропы. С=0,n=γ
– уравнение адиабаты. С=
- показатель политропы. С=0,n=γ
– уравнение адиабаты. С= ,n=1
– уравнение изотермы. С=Ср,
n=0
– уравнение изобары. С=СV,
n=
,n=1
– уравнение изотермы. С=Ср,
n=0
– уравнение изобары. С=СV,
n= - уравнение изобары.
- уравнение изобары.
Лекция 12 Второе начало термодинамики
План
лекции
Круговой процесс
Энтропия
Различные формулировки второго начала термодинамики
Цикл Карно
Круговой процесс.
Круговым процессом называется процесс при котором система пройдя через ряд состояний возвращается в исходное.
Графически, цикл, совершаемый идеальным газом можно разбить на процессы: 1-2 расширение, 2-1 сжатие.
Работа,
совершаемая газом за цикл, определяется
площадью охватываемой замкнутой кривой.
Если за цикл совершается работа А=∫pdv>0
то он называется прямым. Если А “-” то
обратным.
Прямой цикл используется в тепловых двигателях – периодически действующих двигателях совершающих работу за счет полученной извне теплоты. Обратный цикл используется в холодильных машинах – периодически действующих установках в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой.
В
результате кругового процесса система
возвращается в исходное состояние
 тогда
первое началоQ=A
т.е. работа совершаемая за циклом равна
количеству полученной из вне теплоты.
В результате кругового процесса система
может теплоту получать и отдавать.
тогда
первое началоQ=A
т.е. работа совершаемая за циклом равна
количеству полученной из вне теплоты.
В результате кругового процесса система
может теплоту получать и отдавать.
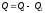 .
.
Термический КПД для кругового процесса равен отношению полезной работы А совершаемой за цикл к количеству теплоты от нагревателя Q.
 1=(Q1-Q2)/Q=1-Q2/Q1
1=(Q1-Q2)/Q=1-Q2/Q1
Термодинамический процесс называется обратимым если он может происходить как в прямом так ив обратном направлении. А если нет то необратимый.
Любой равновесный процесс является обратимым. Обратимые процессы – это идеализация реальных процессов. Они необходимы
Т.к. многие процессы близки к обратимым.
Обратимые процессы являются наиболее экономичными: имеют
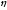 max,
что позволяет указать пути повышения
КПД реальных тепловых двигателей.
max,
что позволяет указать пути повышения
КПД реальных тепловых двигателей.
