
- •Северо-казахстанский
- •Лекция 1. Относительность движения. Закон движения, траектория, путь, перемещение. Векторы скорости и ускорения. Тангенциальное и нормальное ускорение
- •I. Механическое движение
- •III. Траектория, путь и перемещение
- •V. Координатный способ задания движения
- •II. Второй закон Ньютона.
- •III. Третий закон Ньютона.
- •IV. Момент импульса материальной точки, момент силы, момент инерции
- •Лекция 4 Работа силы и мощность. Кинетическая энергия. Консервативные и неконсервативные силы. Потенциальная энергия. Связь силы с потенциальной энергией.
- •II. Механическая мощность
- •III. Кинетическая и потенциальная энергии.
- •Лекция 5 Система материальных точек. Внешние и внутренние силы. Замкнутая система. Закон сохранения импульса. Закон сохранения механической энергии.
- •II. Закон сохранения импульса
- •III. Закон сохранения энергии
- •III Момент инерции и момент силы. Момент импульса системы, закон сохранения момента импульса замкнутой системы
- •Лекция 7 Оси вращения. Условие равновесия тела
- •II. Условия равновесия твёрдого тела. Виды равновесия
- •III. Теорема Гюйгенса-Штейнера
- •Лекция 8 Кинетическая энергия вращения твердого тела. Расчёт моментов инерции различных тел
- •II. Расчет моментов инерции различных тел
- •Лекция 9 Основные положения молекулярно-кинетической теории
- •I Масса и размеры молекул. Идеальный газ. Основное уравнение молекулярно-кинетической теории.
- •II Основные законы идеального газа.
- •III Уравнение состояния идеального газа.
- •IV Температура, как мера средней кинетической энергии.
- •Лекция 10 Распределение Максвелла и Больцмана
- •I Распределение Максвелла.
- •II Барометрическая формула. Распределение Больцмана.
- •III Экспериментальное определение числа Авагадро.
- •Лекция 11 Первое начало термодинамики
- •I Внутренняя энергия.
- •II Работа и теплопередача.
- •III Первое начало термодинамики.
- •IV Теплоемкость.
- •V Применение первого начала термодинамики к изопроцессам.
- •VI Адиабатический процесс. Политропный процесс.
- •Лекция 12 Второе начало термодинамики
- •II Энтропия.
- •III Различные формулировки второго начала термодинамики.
- •IV Цикл Карно.
- •Лекция 13 Процессы переноса
- •I Среднее число столкновений и средняя длина свободного пробега молекул.
- •II Явления переноса.
- •Лекция 14 Реальный газ
- •I Межмолекулярное взаимодействие.
- •II Уравнение Ван–дер-Ваальса.
- •III Изотермы Ван-дер-Ваальса.
- •Лекция 15 Жидкости. Твердые тела. Фазовые переходы
- •I Поверхностное натяжение, капиллярные явления.
- •II Твердые тела.
- •III Фазовые переходы
III Первое начало термодинамики.
Закон
сохранения энергии применительно к
термодинамическим процессам называется
первым началом термодинамики.
Все количество теплоты, переданное системе, идет на изменение внутренней энергии системы и совершаемую системой работу – первое начало термодинамики. Q=ΔU+A (10).
Если система периодически возвращается в исходное состояние, то изменение ее внутренней энергии ΔU=0. Тогда, согласно I началу термодинамики А=Q. Это значит, что невозможно создать периодически действующий механизм, который совершал бы работу, превышающую получаемую им энергию.
Воображаемый механизм, совершающий работу, большую получаемой энергии, называется вечным двигателем первого рода.
Другая формулировка I начала термодинамики: вечный двигатель первого рода невозможен.
Выражение (10) в дифференциальной форме будет иметь вид: δQ=dU+δA (11). Где dU – бесконечно малое изменение внутренней энергии системы, δA – элементарная работа, δQ – бесконечно малое количество теплоты.
IV Теплоемкость.
Теплоемкость – скалярная физическая величина, характеризующая связь между количеством сообщенного системе тепла и изменением температуры этой системы.
Различают полную, молярную и удельную теплоемкости.
Полная теплоемкость численно равна количеству тепла, которое необходимо сообщить системе, чтобы повысить ее температуру на единицу. Сп=δQ/dT (1).
Молярная теплоемкость численно равна количеству тепла, которое необходимо сообщить одному молю вещества, чтобы повысить его температуру на единицу. С=δQ/(νdT) (2).
Удельная теплоемкость численно равна количеству тепла, которое необходимо сообщить единице массы вещества, чтобы повысить его температуру на единицу. с=δQ/(mdT) (3).
Из (2) и (3) найдем связь между молярной и удельной теплоемкостями. Учитывая, что ν=m/M, получим С=Мс (4). Теплоемкость зависит от свойств вещества, от температуры, а для газов от характера процесса, при котором система получает тепло. Рассмотрим теплоемкость газов.
V=const. I начало термодинамики: δQ=dU+δA, т.к.δА=рdV, а при V=const, dV=0=> δQ=dU. Подставим в (2), получим СV =dU/(νdT). Для идеального газа
 ,
тогда
,
тогда (5).
Для одноатомного газаi=3
и
(5).
Для одноатомного газаi=3
и
 ,
для двухатомного – i=5
и
,
для двухатомного – i=5
и
 ,
для многоатомного –i=6
и
,
для многоатомного –i=6
и
 .
.р=const. Продифференцируем уравнение Менделеева – Клапейрона по Т: pdV=νRdT. Из (2)
 ,
, (6).
Из (5) и (6)Cp=CV+R
(7) – уравнение Майера. Разделим (6) на
(5)
(6).
Из (5) и (6)Cp=CV+R
(7) – уравнение Майера. Разделим (6) на
(5)
 (8).
(8).
V Применение первого начала термодинамики к изопроцессам.
1
Изохорный
процесс
(V=cobst).
δА=рdV=0
и I
начало термодинамики
 (9).
(9).
2
Изобарный
процесс
(p=const).
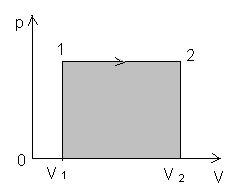
Начертим график в координатах рV.
При изобарном процессе работа газа при
расширении объема от V1до
V2
равна
 и определяется площадью прямоугольника.
Воспользуемся уравнением Менделеева
– Клапейрона
и определяется площадью прямоугольника.
Воспользуемся уравнением Менделеева
– Клапейрона (10) и выразим
(10) и выразим .Физический
смысл R:
R
численно равно работе изобарного
расширения 1 моля идеального газа при
нагревании его на 1 К.
.Физический
смысл R:
R
численно равно работе изобарного
расширения 1 моля идеального газа при
нагревании его на 1 К.
I начало термодинамики для изобарного процесса: δQ=dU+δA (11).
3
Изотермический
процесс
(Т=const).
Найдем работу изотермического расширения
газа:
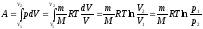 (12), т.кp1V1=p2V2.
Т.к. T=const,
то dU=0
и из I
начала термодинамики δQ=δA
(13).
(12), т.кp1V1=p2V2.
Т.к. T=const,
то dU=0
и из I
начала термодинамики δQ=δA
(13).
