
- •1. Сраго, и.А. Неорганическая химия. Учебно-методический комплекс/и.А. Сраго, м.Н. Рябова. – сПб.: сзту, 2010.
- •Перечень (2) специальных названий бинарных соединений водорода
- •Перечень (3) специальных названий бинарных соединений кислорода
- •«Водорода»
- •Перечень (6) эталонных простых веществ
- •Правила определения степеней окисления.
- •Номенклатура комплексов и кс
Правила определения степеней окисления.
1) В простых веществах степени
окисления равны нулю, например Сu0,
S .
.
2) Некоторые элементы в сложных веществах и в ионах имеют, как правило, постоянные степени окисления, в частности:
а) у элементов IA-группы, II группы (кроме Hg) и III группы (кроме B и Tl) периодической системы (см. табл. 1) степень окисления равна номеру группы со знаком «+», например K+1NO3, Be+2SO4, Al+3F3;
б) у водорода степень окисления равна
+1, кроме соединений с элементами,
перечисленными в п. а), а также с бором
и с кремнием, в которых степень окисления
водорода составляет -1, например H+1Br,
но B2H ;
;
в) у кислорода степень окисления равна
-2, кроме пероксидов, надпероксидов,
озонидов и соединений со фтором, например
CCl2O-2,
H2O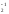 (пероксид водорода), KO
(пероксид водорода), KO (надпероксид калия), RbO
(надпероксид калия), RbO (озонид рубидия), O
(озонид рубидия), O F2
(дифторид дикислорода);
F2
(дифторид дикислорода);
г) у элементов VIIA-группы
периодической системы (см. табл. 1)
степень окисления равна -1, причем у
фтора всегда, а у остальных галогенов,
кроме соединений со фтором, кислородом,
азотом и между собой, например, H[РF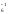 ],
BCl
],
BCl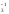 ,
Br
,
Br N;
N;
3) Сумма степеней окисления всех атомных частиц в молекуле (или в формульной единице вещества немолекулярного строения) равна нулю, а в ионе - заряду этого иона.
Алгоритм нахождения коэффициентов в уравнениях ОВР с помощью электронных уравнений (методом электронного баланса):
-
расставляем степени окисления всех элементов;
-
находим элементы, изменяющие с.о.;
-
составляем электронные уравнения полуреакций;
-
у каждого электронного уравнения ставим множитель, равный числу электронов в другом уравнении, и сокращаем (если необходимо) эти множители;
-
умножаем уравнения полуреакций на полученные множители и складываем полученные произведения между собой (электроны при этом должны взаимно уничтожаться);
-
переносим полученные коэффициенты (с учетом индексов) в схему реакции;
-
находим остальные коэффициенты, основываясь на материальном балансе, в следующей последовательности:
а) соли - баланс по катионам металлов, б) кислоты - баланс по кислотным остаткам (или щелочи - баланс по катионам металлов), в) вода - баланс по водороду.
Алгоритм составления уравнения ОВР ионно-электронным методом:
1) составляем схемы полуреакций вида «реагент А продукт В» (обе частицы содержат элемент, изменяющий свою степень окисления);
2) уравниваем схемы по элементам, изменяющим свои степени окисления;
3) сравниваем количество вещества О-2 в правых и левых частях полученных схем, уточняем рН среды и добавляем в обе части каждой из схем формулы Н+, ОH−, или Н2О, причем, какие именно формулы надо добавлять, определяем по следующей блок-схеме:

4) уравниваем полученные схемы по кислороду, затем по водороду;
5) уравниваем схемы по зарядам, добавляя или отнимая электроны слева;
-
у каждого уравнения полуреакции ставим множитель, равный числу электронов в другом уравнении, и сокращаем (если необходимо) эти множители;
-
умножаем уравнения полуреакций на полученные множители и складываем полученные произведения между собой;
-
приводим подобные (если необходимо) в обеих частях уравнения и получаем краткие ионные уравнения ОВР;
-
добавляем к обеим частям кратких ионных уравнений формулы ионов, входящих в состав реагентов, но не участвующих в полуреакциях, в таких количествах, чтобы суммарные заряды обеих частей были нулевыми;
10.) объединяем формулы катионов с формулами анионов в формулы веществ в соответствии с электронейтральностью веществ и получаем молекулярные уравнения ОВР.
Таблица 13. Важнейшие восстановители и продукты их окисления (е0 – стандартный потенциал металла М при 298 К, В – см. табл. 15)
|
Вещества-восстановители |
Металлы М при взаимодействии с |
||||
|
H2SО4(разб) и НСl |
Н2О |
концентрированным раствором щелочи (окислитель - Н2О) |
|||
|
Частицы-восстановители |
М |
||||
|
Частицы-продукты окисления |
Мх+ (е0 < 0, в том числе Сr2+, Fe2+, Ti3+) |
Мх+ (е0 < -2,6); М(ОН)x (М = Ga и -2,6 < е0 < -1,6) |
[M(OН)4]2- (М = Ве, Со, Fe, Рb, Sn, Zn); [M(OH)4]- (M = Al, Ga); МO MO |
||
|
Вещества-восстановители |
HBr, HI, H2S и их соли |
SO2, H2SO3 и сульфиты |
FeSO4, FeCl2 (соли Fe2+) |
SnCl2
|
|
|
Частицы-восста- новители |
Вг |
SO2, H2SO3 и SO |
Fe2+ |
Sn2+ |
|
|
Частицы-продукты окисления |
Вг2, I2 и S |
SО S2O |
Fe3+ рH < 7 |
SnIV рH 7 |
SnO рH > 7 |
Таблица 14. Важнейшие окислители и продукты их восстановления (Г – галоген)
|
Вещества-окислители |
Г2 (Г = Вr, Cl, F, I) |
О2 |
HNO3 |
Н2O |
HCl |
H2SO4 разб. |
|||||||||||||
|
разб. |
конц. |
||||||||||||||||||
|
Частицы-окислители |
Г2 |
О2 |
NO |
Н2O |
H+ |
||||||||||||||
|
Частицы – продукты восстановления |
Г- |
ОН- рН 7 |
Н2О рН<7 |
NO |
NО2 |
H2 |
|||||||||||||
|
Вещества-окислители |
H2SO4 конц. |
K2Cr2О7 |
K2CrО4 |
FeCl3, Fe(NО3)3 |
РbO2 |
||||||||||||||
|
Частицы-окислители |
SO |
Cr2О |
CrО |
Fe3+ |
РbO2 |
||||||||||||||
|
Частицы – продукты восстановления |
SО2 |
Cr3+ рН < 7 |
Fe2+ |
Рb2+ рН ≤ 7 |
[Рb(OH)4]2- рН > 7 |
||||||||||||||
|
Вещества-окислители |
КГО3 |
NaГO |
MnO2 |
КМnО4 |
|||||||||||||||
|
Частицы-окислители |
ГО |
ГО- |
MnO2 |
МnО |
|||||||||||||||
|
Частицы – продукты восстановления |
Г- (чаще) или Г2 |
Мn2+ рН <7 |
MnO2 7 ≤ рН <12 |
МnО рН >12 |
|||||||||||||||
Таблица 15. Стандартные потенциалы металлов е0 при 298 К
|
Mx+ /M |
e0, В |
Mx+ /M |
e0, В |
Mx+ /M |
e0, В |
Mx+ /M |
e0, В |
|
Ac3+/Ac |
-2,600 |
Со2+/Со |
-0,277 |
La3+/La |
-2,522 |
Rb+/Rb |
-2,925 |
|
Al3+/Аl |
-1,662 |
Сr2+/Cr |
-0,913 |
Li+/Li |
-3,045 |
Rh3+/Rh |
+0,800 |
|
Ag+/Аg |
+0,799 |
Сu2+/Сu |
+0,337 |
Mg2+/Mg |
-2,363 |
Ru2+/Ru |
+0,450 |
|
Аu3+/Аu |
+1,498 |
Fе2+/Fе |
-0,440 |
Мn2+/Мn |
-1,180 |
Sb3+/Sb |
+0,240 |
|
Ва2+/Ва |
-2,906 |
Ga3+/Ga |
-0,560 |
Nа+/Nа |
-2,711 |
Sc3+/Sc |
-2,077 |
|
Ве2+/Ве |
-1,847 |
Н+/Н2 |
0,000 |
Ni2+/Ni |
-0,250 |
Sn2+/Sn |
-0,136 |
|
Вi3+/Bi |
+0,214 |
Нg2+/Нg |
+0,854 |
Рb2+/Рb |
-0,126 |
Sr2+/Sr |
-2,888 |
|
Са2+/Са |
-2,864 |
In 3+/In |
-0,343 |
Рd2+/Рd |
+0,915 |
Т1+/Т1 |
-0,336 |
|
Сs+/Сs |
-2,923 |
Ir3+/Ir |
+1,000 |
Рt2+/Рt |
+0,963 |
Y3+/Y |
-2,372 |
|
Cd2+/Cd |
-0,403 |
K+/K |
-2,924 |
Rа2+/Rа |
-2,916 |
Zn2+/Zn |
-0,763 |
Перечень (9) «Ряд перенапряжений»
Pb Нg Сd Zn Al Sb Аu Sn Ag Сu Fe Bi Ni Co Pd Pt
Таблица 16. Электронные уравнения электродных процессов, протекающих при электролизе водных растворов электролитов состава MbAnc, на нертутных катодах и инертных анодах
|
на катоде |
на аноде |
|
2H2O + 2e = H2 + 2OH- (при e0 < -1,6 В) |
2An- - 2e = An2 (при An = Br, Cl, I) |
|
An2- - 2e = An (при An = S, Se, Te) |
|
|
Mx+
+ xe
= M 2H2O + 2e = H2 + 2OH- (при -1,6 В < e0 < -0,15 В) |
2H2O - 4e = O2 + 4H+ (при An = AsO4, CO3, ClO4, F, РO4, NO3, SO4, SeO4) |
|
Mx+ + xe = M (при e0 > -0,15 В) |
4OH- - 4e = O2 + 2H2O (при An = OH) |
Примечание. e0 – стандартный потенциал металла M (см. табл.15), В; An – кислотный остаток или OH.
Таблица 17. Квантовые числа
|
Квантовые числа |
Главное n |
Орбитальное l |
Магнитное m |
Спин s |
|
Возможные значения квантовых чисел |
Любое натуральное число от 1 по 7 |
Любое целое число от 0 по n-1 (l ≤ 3) |
Любое целое число от -l по l |
-1/2 и 1/2 |
|
Обозначения значений |
1 − K; 2 – L; 3 – M; 4 – N; 5 – O; 6 – Р; 7 - Q |
0 – s; 1 – р; 2 – d; 3 – f |
отсутствуют |
-1/2 - ↓; 1/2 - ↑ |
|
Свойства, определяемые значениями данного квантового числа |
Размер АО; энергия АО и электрона |
Форма АО; энергия АО и электрона |
Пространственная ориентация АО (при l > 0); форма АО (при l = 2 и 3) |
Магнитные свойства электрона |
Таблица 18. Обозначения и геометрические формы АО при различных значениях орбитального квантового числа l
|
Значение l |
Обозначение АО |
Геометрические формы АО |
|
0 |
ns-орбиталь |
|
|
1 |
nр-орбиталь |
|
|
2 |
nd-орбиталь |
|
|
3 |
nf-орбиталь |
|
Рисунок 1. Пространственная ориентация трех np-орбиталей одного подуровня

Таблица 19. Количества подуровней, АО и электронов на уровнях, подуровнях и АО
|
Число |
На уровне |
На подуровне |
На АО |
|
подуровней |
n , при n = 1, 2, 3, 4;
4, при n = 5, 6, 7 |
1 |
- |
|
АО
|
n2
,
при
n
= 1,
2, 3,
4;
16 , при n = 5, 6, 7 |
2l + 1 на ns - 1; на пр - 3; на пd -5; на nf - 7 |
1 |
|
электронов (максимальное число) |
2n2
,
при
n
= 1,
2, 3,
4;
32, при n = 5, 6, 7 |
41 + 2 на ns - 2; на пр - 6; на пd - 10; на nf - 14 |
2 |
Таблица 20. Электронные и электронно-графические формулы атомов элементов в основном состоянии (подчеркнуты обозначения валентных электронов)
|
Символ элемента |
Электрон-ное семейство |
Краткая электронная формула атома в основном состоянии |
Электронно-графическая формула атома в основном состоянии |
|
Ac |
f |
[Rn]6d17s2 |
|
|
Ag |
d |
[Kr]4d105s1 |
|
|
Al |
р |
[Ne]3s23р1 |
|
|
Am |
f |
[Rn]5f77s2 |
|
|
Ar |
р |
[Ne]3s23р6 |
|
|
As |
р |
[Ar]3d104s24р3 |
|
|
At |
р |
[Xe]4f145d106s26р5 |
|
|
Au |
р |
[Xe]4f145d106s1 |
|
|
B |
p |
[He]2s22р1 |
|
|
Ba |
s |
[Xe]6s2 |
|
|
Be |
s |
[He]2s2 |
|
|
Bh |
d |
[Rn]5f146d57s2 |
|
|
Bi |
p |
[Xe]4f145d106s26р3 |
|
|
Bk |
f |
[Rn]5f86d17s2 |
|
|
Br |
p |
[Ar]3d104s24р5 |
|
|
C |
p |
[He]2s22р2 |
|
|
Ca |
s |
[Ar]4s2 |
|
|
Символ элемента |
Электрон-ное семейство |
Краткая электронная формула атома в основном состоянии |
Электронно-графическая формула атома в основном состоянии |
|
Cd |
d |
[Kr]4d105s2 |
|
|
Ce |
f |
[Xe]4f15d16s2 |
|
|
Cf |
f |
[Rn]5f107s2 |
|
|
Cl |
p |
[Ne]3s23р5 |
|
|
Cm |
f |
[Rn]5f76d17s2 |
|
|
Co |
d |
[Ar]3d74s2 |
|
|
Cr |
d |
[Ar]3d54s1 |
|
|
Cs |
s |
[Xe]6s1 |
|
|
Cu |
d |
[Ar]3d104s1 |
|
|
Db |
d |
[Rn]5f146d37s2 |
|
|
Ds |
d |
[Rn]5f146d87s2 |
|
|
Dy |
f |
[Xe]4f106s2 |
|
|
Er |
f |
[Xe]4f126s2 |
|
|
Es |
f |
[Rn]5f117s2 |
|
|
Eu |
f |
[Xe]4f76s2 |
|
|
F |
p |
[He]2s22р5 |
|
|
Fe |
d |
[Ar]3d64s2 |
|
|
Fm |
f |
[Rn]5f127s2 |
|
|
Fr |
s |
[Rn]7s1 |
|
|
Ga |
p |
[Ar]3d104s24р1 |
|
|
Gd |
f |
[Xe]4f75d16s2 |
|
|
Ge |
p |
[Ar]3d104s24р2 |
|
|
H |
s |
1s1 |
|
|
He |
s |
1s2 |
|
|
Hf |
d |
[Xe]4f145d26s2 |
|
|
Hg |
d |
[Xe]4f145d106s2 |
|
|
Ho |
f |
[Xe]4f116s2 |
|
|
Hs |
d |
[Rn]5f146d67s2 |
|
|
I |
p |
[Kr]4d105s25р5 |
|
|
In |
p |
[Kr]4d105s25р1 |
|
|
Ir |
d |
[Xe]4f145d76s2 |
|
|
K |
s |
[Ar]4s1 |
|
|
Символ элемента |
Электрон-ное семейство |
Краткая электронная формула атома в основном состоянии |
Электронно-графическая формула атома в основном состоянии |
|
Kr |
p |
[Ar]3d104s24р6 |
|
|
La |
f |
[Xe]5d16s2 |
|
|
Li |
s |
[He]2s1 |
|
|
Lr |
d |
[Rn]5f146d17s2 |
|
|
Lu |
d |
[Xe]4f145d16s2 |
|
|
Md |
f |
[Rn]5f137s2 |
|
|
Mg |
s |
[Ne]3s2 |
|
|
Mn |
d |
[Ar]3d54s2 |
|
|
Mo |
d |
[Kr]4d55s1 |
|
|
Mt |
d |
[Rn]5f146d77s2 |
|
|
N |
p |
[He]2s22р3 |
|
|
Na |
s |
[Ne]3s1 |
|
|
Nb |
d |
[Kr]4d45s1 |
|
|
Nd |
f |
[Xe]4f46s2 |
|
|
Ne |
p |
[He]2s22р6 |
|
|
Ni |
d |
[Ar]3d84s2 |
|
|
No |
f |
[Rn]5f147s2 |
|
|
Nр |
f |
[Rn]5f46d17s2 |
|
|
O |
p |
[He]2s22р4 |
|
|
Os |
d |
[Xe]4f145d66s2 |
|
|
Р |
p |
[Ne]3s23р3 |
|
|
Рa |
f |
[Rn]5f26d17s2 |
|
|
Рb |
p |
[Xe]4f145d106s26р2 |
|
|
Рd |
d |
[Kr]4d105s0 |
|
|
Рm |
f |
[Xe]4f56s2 |
|
|
Рo |
p |
[Xe]4f145d106s26р4 |
|
|
Рr |
f |
[Xe]4f36s2 |
|
|
Рt |
d |
[Xe]4f145d96s1 |
|
|
Рu |
f |
[Rn]5f67s2 |
|
|
|
|
|
|
|
Rb |
s |
[Kr]5s1 |
|
|
Re |
d |
[Xe]4f145d56s2 |
|
|
Rf |
d |
[Rn]5f146d27s2 |
|
|
Символ элемента |
Электрон-ное семейство |
Краткая электронная формула атома в основном состоянии |
Электронно-графическая формула атома в основном состоянии |
|
Rg |
d |
[Rn]5f146d107s1 |
|
|
Rh |
d |
[Kr]4d85s1 |
|
|
Rn |
p |
[Xe]4f145d106s26р6 |
|
|
Ru |
d |
[Kr]4d75s1 |
|
|
S |
p |
[Ne]3s23р4 |
|
|
Sb |
p |
[Kr]4d105s25р3 |
|
|
Sc |
d |
[Ar]3d14s2 |
|
|
Se |
p |
[Ar]3d104s24р4 |
|
|
Sg |
d |
[Rn]5f146d47s2 |
|
|
Si |
p |
[Ne]3s23р2 |
|
|
Sm |
f |
[Xe]4f66s2 |
|
|
Sn |
p |
[Kr]4d105s25р2 |
|
|
Sr |
s |
[Kr]5s2 |
|
|
Ta |
d |
[Xe]4f145d36s2 |
|
|
Tb |
f |
[Xe]4f96s2 |
|
|
Tc |
d |
[Kr]4d55s2 |
|
|
Te |
p |
[Kr]4d105s25р4 |
|
|
Th |
f |
[Rn]6d27s2 |
|
|
Ti |
d |
[Ar]3d24s2 |
|
|
Tl |
p |
[Xe]4f145d106s26р1 |
|
|
Tm |
f |
[Xe]4f136s2 |
|
|
U |
f |
[Rn]5f36d17s2 |
|
|
V |
d |
[Ar]3d34s2 |
|
|
W |
d |
[Xe]4f145d46s2 |
|
|
Xe |
p |
[Kr]4d105s25р6 |
|
|
Y |
d |
[Kr]4d15s2 |
|
|
Yb |
f |
[Xe]4f146s2 |
|
|
Zn |
d |
[Ar]3d104s2 |
|
|
Zr |
d |
[Kr]4d25s2 |
|
Таблица 21. Формы высших оксидов и гидроксидов элементов
|
номер группы |
I |
II |
III |
IV |
V |
VI |
VII |
|
формулы высших оксидов |
Э2O |
ЭO |
Э2O3 |
ЭO2 |
Э2O5 |
ЭO3 |
Э2O7 |
|
формулы высших гидроксидов
|
ЭOH
|
Э(OH)2
|
Э(OH)3
|
H2ЭO3 (Э = C,Si), или Э(OH)4 (Э ≠ C,Si) |
HЭO3
|
H2ЭO4
|
HЭO4
|
Таблица 22. Характер изменения некоторых свойств элементов в периодах и в подгруппах с ростом порядкового номера
|
Свойства элементов |
Характер изменения с ростом атомного номера |
|
|
в периоде |
в подгруппе |
|
|
Атомные и ионные радиусы |
|
|
|
Энергии ионизации |
|
(в А-группе) |
|
Сродство к электрону |
VΊΙ А-max; VIIIA-min |
– |
|
Электроотрицательности |
|
|
|
Неметаллические свойства |
|
|
|
Металлические свойства |
|
|
|
Окислительные свойства |
|
|
|
|
– |
(в B-группе) |
|
Восстановительные свойства |
|
|
|
|
– |
(в А-группе) |
|
Кислотно-оснóвные свойства оксидов и гидроксидов |
кислотные - |
кислотные - |
|
оснóвные - |
оснóвные - |
|
|
Плотность простого вещества |
max - в середине |
|
|
Энтропия простого вещества |
– |
|
Примечание. - возрастают, усиливаются; - убывают, ослабевают; max – максимум; min – минимум; const – не изменяется; прочерк – нет определенного характера изменения.
Таблица 23. Формы водородных соединений элементов
|
Номер группы |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
Формы водородных соединений |
ЭН |
ЭН2 |
ЭН3 |
ЭН4 |
ЭH3 |
Н2Э |
НЭ |
|
|
твердые |
газообразные (летучие) |
|||||
Таблица 24. Способы перекрывания АО и виды связей
|
перекрывающиеся АО связанных атомных частиц |
вид связи |
схема перекрывания АО |
|
s-АО и s-АО |
σ-связь
|
|
|
s-АО и р-АО |
|
|
|
s-АО и d-АО |
|
|
|
р-АО и р-АО |
|
|
|
р-АО и d-АО |
|
|
|
d-АО и d-АО |
|
|
|
гибридная АО и s-АО |
|
|
|
гибридная АО и р-АО |
|
|
|
р-АО и р-АО |
π-связь |
|
|
р-АО и d-АО |
|
|
|
d-АО и d-АО |
|
|
|
d-АО и d-АО |
δ-связь |
|
Таблица 25. Электроотрицательности по Полингу (ЭО) некоторых элементов:
|
Элемент |
As |
B |
Ba |
Be |
Br |
C |
Ca |
Cl |
Cs |
F |
Ge |
H |
I |
|
ЭО |
2,0 |
2,0 |
0,9 |
1,5 |
2,8 |
2,5 |
1,0 |
3,0 |
0,7 |
4,0 |
1,8 |
2,1 |
2,5 |
|
Элемент |
K |
Li |
N |
Na |
O |
P |
Rb |
S |
Se |
Si |
Sr |
Te |
Zn |
|
ЭО |
0,8 |
1,0 |
3,0 |
0,9 |
3,5 |
2,1 |
0,8 |
2,5 |
2,4 |
1,8 |
0,9 |
2,1 |
1,7 |
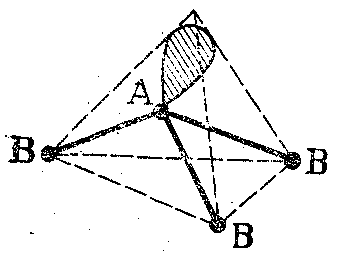
Таблица 26. Геометрическая форма молекулярной частицы состава АВz в зависимости от типа гибридизации валентных АО атомной частицы А
|
Тип гибридизации |
Расположение в пространстве гибридных АО |
Состав АВz |
Геометрическая форма молекулярной частицы |
|
|
sр |
из середины отрезка к его концам |
АВ2 |
|
линейная |
|
sр2 |
из центра тяжести правильного треугольника к его вершинам |
•АВ2, :АВ2 |
|
угловая |
|
АВ3 |
|
плоскотреугольная |
||
|
sр3 |
из центра тяжести правильного тетраэдра к его вершинам
|
::АВ2 |
|
угловая |
|
:АВ3 |
|
треугольно-пирамидальная
|
||
|
АВ4 |
|
тетраэдрическая |
||
|
sр3d |
из центра тяжести треугольной бипирамиды к ее вершинам |
:::АВ2 |
|
линейная |
|
::АВ3 |
|
Т-образная |
||
|
:АВ4 |
|
«качели» |
||
|
АВ5 |
|
треугольно-бипирамидальная
|
||
|
sр3d2 |
из центра тяжести правильного октаэдра к его вершинам |
::АВ4 |
|
квадратная |
|
:АВ5 |
|
квадратно-пирамидальная |
||
|
АВ6 |
|
октаэдрическая |
||
|
sр3d3 |
из центра тяжести пятиугольной бипирамиды к ее вершинам |
АВ7 |
|
пятиугольно- бипирамидаль- ная |
АЛГОРИТМ ОПРЕДЕЛЕНИЯ ГЕОМЕТРИЧЕСКОЙ ФОРМЫ МОЛЕКУЛЯРНОЙ ЧАСТИЦЫ ABz (А – s- или р-элемент; z > 1; заряд опущен):
1. Определяем степени окисления элементов А и В ±α и ±β соответственно.
2. Составляем
электронно-графические формулы ионов
 и
и
 ,
заряды которых равны
степеням окисления, в основных состояниях,
учитывая,
что при
составлении формул катионов s-
и
р-элементов
обозначения
электронов удаляются из формул атомов
справа
налево
по формуле с полным освобождением
квантовых ячеек.
,
заряды которых равны
степеням окисления, в основных состояниях,
учитывая,
что при
составлении формул катионов s-
и
р-элементов
обозначения
электронов удаляются из формул атомов
справа
налево
по формуле с полным освобождением
квантовых ячеек.
3. Определяем
функции ионов
 и
и
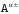 (донор
или акцептор)
при образовании σ-связей А–В,
используя следующую
схему:
(донор
или акцептор)
при образовании σ-связей А–В,
используя следующую
схему:

Если ион
 является донором, то
ион
является донором, то
ион
 – акцептор; если
ион
– акцептор; если
ион
 является акцептором,
то ион
является акцептором,
то ион
 – донор.
– донор.
4. На электронно-графической
формуле иона
 находим z
валентных орбиталей,
участвующих в
образовании σ-связей А–В
в последовательности
ns-,
пр-,
пd-АО
(где n
– номер внешнего
уровня
находим z
валентных орбиталей,
участвующих в
образовании σ-связей А–В
в последовательности
ns-,
пр-,
пd-АО
(где n
– номер внешнего
уровня  ).
Изображаем эти связи
стрелками, соединяющими формулы ионов
).
Изображаем эти связи
стрелками, соединяющими формулы ионов
 с
соответствующими квантовыми ячейками
в электронно-графической формуле иона
с
соответствующими квантовыми ячейками
в электронно-графической формуле иона
 (стрелки направлены
от донора к акцептору).
(стрелки направлены
от донора к акцептору).
5. На электронно-графической
формуле иона
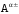 определяем тип
гибридизации, считая что ей подвергаются
все валентные АО,
содержащие
электроны (в
последовательности ns-,
nр-,
nd-),
и все
пустые АО,
образующие
б-связи.
Соответствующие квантовые ячейки
объединяются фигурной скобкой.
определяем тип
гибридизации, считая что ей подвергаются
все валентные АО,
содержащие
электроны (в
последовательности ns-,
nр-,
nd-),
и все
пустые АО,
образующие
б-связи.
Соответствующие квантовые ячейки
объединяются фигурной скобкой.
6. Находим
число неподеленных пар НП (либо
неподеленный электрон НЭ) у иона
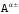 (это пары валентных электронов или
неспаренный валентный электрон, не
участвующие в образовании σ-связей А–В)
и по табл. 26 определяем
геометрическую форму частицы
ΑΒz.
(это пары валентных электронов или
неспаренный валентный электрон, не
участвующие в образовании σ-связей А–В)
и по табл. 26 определяем
геометрическую форму частицы
ΑΒz.
Таблица 27. Важнейшие органические лиганды
|
Буквенное обозначение |
Заряд |
Дентат- ность |
Специальное название |
|
acac |
–1 |
2 |
ацетилацетонато |
|
biрy |
0 |
2 |
2,2′–бипиридил |
|
cр |
–1 |
3 |
циклопентадиенил |
|
dien |
0 |
3 |
диэтилентриамин |
|
dmg |
–1 |
2 |
диметилглиоксимато |
|
edta |
–4 |
6 |
этилендиаминтетраацетато |
|
en |
0 |
2 |
этилендиамин |
|
gly |
–1 |
2 |
глицинато |
|
ox |
–2 |
2 |
оксалато |
|
phen |
0 |
2 |
1,10–фенантролин |
|
ру |
0 |
1 |
пиридин |
|
ur |
0 |
1 |
карбамид |
Таблица 28. Специальные названия лигандов
|
Формула лиганда |
Специальное название лиганда |
Формула лиганда |
Специальное название лиганда |
|
AsO |
арсенато |
NH3 |
аммин |
|
Br |
бромо |
N2H4 |
гидразин |
|
BrO |
бромато |
|
гидразиний |
|
CH3COO |
ацетато |
NH2OH |
гидроксиламин |
|
CN |
циано |
NO |
нитрозил |
|
CO |
карбонил |
NO+ |
нитрозилий |
|
CS |
тиокарбонил |
NO |
нитроилий |
|
|
оксалато |
NO |
нитро |
|
Cl |
хлоро |
NO |
нитрато |
|
ClO |
хлорато |
O2 |
дикислород |
|
ClO |
перхлорато |
O |
оксо |
|
F |
фторо |
|
пероксо |
|
H+ |
гидро |
OH |
гидроксо |
|
H |
гидридо |
P(C6H5)3 |
трифенилфосфин |
|
HS |
меркапто |
PF3 |
трифторофосфор |
|
H2O |
аква |
PH3 |
фосфин |
|
I |
иодо |
PO |
ортофосфато |
|
IO |
иодато |
|
дифосфато |
|
N |
нитридо |
S |
тио |
|
NH2– |
имидо |
SO |
сульфито |
|
|
амидо |
SO3S2– |
тиосульфато |
|
N2 |
диазот |
SO |
сульфато |
|
N |
азидо |
S2O |
дисульфато |
|
NCS |
тиоцианато |
SiO |
метасиликато |
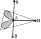
АЛГОРИТМ ОПРЕДЕЛЕНИЯ ГЕОМЕТРИЧЕСКОЙ ФОРМЫ КОМПЛЕКСА, образованного атомной частицей d‑элемента.
1. Определяем степень окисления комплексообразователя.
2. Изображаем электронно-графическую формулу комплексообразователя как катиона с зарядом, равным степени окисления, в основном состоянии учитывая, что при составлении формул катионов d‑элементов обозначения электронов удаляются из формул атомов справа налево по формуле при соблюдении правила Гунда.
3. Используя нижеприведенную блок-схему, определяем состояние комплексообразователя (основное или возбужденное за счет спаривания электронов). В случае нахождения комплексообразователя в возбужденном состоянии составляем соответствующую электронно-графическую формулу.

4. Определяем дентатности лигандов и КЧ комплексообразователя. Используя табл. 29, на электронно-графической формуле комплексообразователя находим валентные АО, участвующие в образовании σ-связей Э←L и в гибридизации, в последовательности ns-, (n−l)d-, np-, nd-АО (где n – номер внешнего уровня комплексообразователя), число которых равно КЧ. Если КЧ = 5, или 6, то в гибридизации участвуют не более двух (n−l)d-АО. Изображаем эти связи стрелками, соединяющими формулы лигандов (с учетом их дентатностей) с соответствующими квантовыми ячейками в электронно-графической формуле комплексообразователя (стрелки направлены от лиганда к комплексообразователю), т.е. от аниона к катиону). Определяем тип гибридизации, объединяя соответствующие квантовые ячейки фигурной скобкой.
7. По значению КЧ и (иногда) типу гибридизации валентных АО комплексообразователя и характеру лигандов с помощью табл.29 определяем геометрическую форму комплекса.
Таблица 29. Зависимость геометрической формы комплекса от типа гибридизации валентных АО комплексообразователя и его координационного числа КЧ
|
КЧ |
Типы гибридизации |
Лиганды |
Геометрическая форма |
|
2 |
sp |
Любые |
линейная |
|
3 |
sp2; d2s |
Любые |
плоскотреугольная |
|
4 |
sp3; d3s; dp3 |
Любые |
тетраэдрическая |
|
dsp2 |
Любые |
плоскоквадратная |
|
|
5 |
dsp3; d2sp2 |
Разные |
квадратно-пирамидальная (комплек- сообразователь над основанием) |
|
sp3d; dsp3; d2p3 |
Любые |
треугольно-бипирамидальная |
|
|
6 |
sp3d2; dsp3d; d2sp3 |
Любые |
октаэдрическая |
|
7 |
d5sp |
Разные |
одношапочная октаэдрическая |
|
Одинаковые |
одношапочная треугольно-призматическая |
||
|
d3sp3 |
Любые |
пятиугольно-бипирамидальная |
|
|
8 |
d5sp2 |
Любые бидентатные |
додекаэдрическая |
|
Любые монодентатные |
квадратно-антипризматическая |
||
|
9 |
d5sp3 |
Одинаковые |
трехшапочная треугольно-призматическая |

 (М = Тi);
(М = Тi); (M = Nb, Ta)
(M = Nb, Ta) ,
I
,
I ,
H2S
и S2-
,
H2S
и S2-
 или
или

























































































































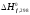 высших оксидов
высших оксидов водородных соединений(г)
водородных соединений(г)


















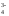


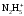











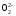 (
( )
)














