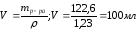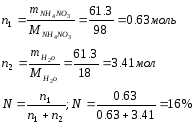Задача n 114
Произведите необходимые вычисления и найдите недостающие величины, обозначенные знаком "?" в строке табл.6, соответствующей номеру Вашей задачи (все растворы – водные).
|
Номер задачи |
Растворенное вещество |
Масса растворенного вещества, г |
Масса рас- творителя, г |
Объем раствора, мл |
Плотность раствора, г/см3 |
Массовая доля, % |
Мольная доля, % |
Молярная концентрация, моль/л |
|
114 |
NH4NO3 |
? |
61,3 |
? |
1,23 |
50 |
? |
? |
Масса раствора (m) представляет собой сумму масс растворителя (m1) и растворенного вещества (m2): m = m1 + m2
Плотность раствора (ρ) есть отношение массы раствора (m) к его объему (V):
 .
.
Массовая доля – отношение массы растворенного вещества к массе раствора – может быть вычислена по формуле:
 ,
,
где m1 – масса растворителя (кг), m2 – масса растворенного вещества (кг), m – масса раствора (m = m1 + m2) (кг).
Молярная (мольная) доля Х – это отношение количества растворенного вещества к общему количеству вещества в растворе:
 ,
,
где n1 – количество растворителя (моль), n2 – количество растворенного вещества (моль), n – общее количество вещества в растворе (n = n1 + n2) (моль).
Массовая и мольная доли – безразмерные величины. Их можно выразить в процентах (x100%).
Молярная концентрация СM – это количество растворенного вещества в единице объема раствора:
 ,
,
где п2 – количество растворенного вещества (моль), m2 – масса растворенного вещества (кг), М2 – молярная масса растворенного вещества (кг/моль), V – объем раствора (м3).
В соответствии с требованиями СИ молярная концентрация выражается в моль/м3.
Произведем необходимые расчеты:

Запишем полученные результаты в исходную таблицу:
|
Номер задачи |
Растворенное вещество |
Масса растворенного вещества, г |
Масса рас- творителя, г |
Объем раствора, мл |
Плотность раствора, г/см3 |
Массовая доля, % |
Мольная доля, % |
Молярная концентрация, моль/л |
|
114 |
NH4NO3 |
61.3 |
61,3 |
100 |
1,23 |
50 |
16 |
6.3 |
Задача n 132
Для реакций:
Na2SeO3 + Cl2 + NaOH → Na2SeO4 + NaCl + H2O
H2MnO4 →HMnO4 +MnO2+H2O
Составьте уравнения методом электронного баланса. Для каждой реакции укажите, какое вещество является окислителем, а какое – восстановителем и за счет каких атомов. Определите типы данных окислительно-восстановительных реакций.
Решение
Окислительно-восстановительные реакции характеризуются переходом электронов от одного вещества (восстановителя) к другому (окислителю).
Для ответов на вопросы задачи вычислим степени окисления атомов, входящих в состав приведенных в уравнении реакции веществ, руководствуясь следующими правилами:
- степени окисления атомов в простых веществах (построенных из атомов одного и того же элемента) принимаются равными нулю;
- степень окисления атома водорода в соединениях с неметаллами равна +1;
- степень окисления атома кислорода в большинстве его соединениях равна -2 (к исключениям из правила относятся, например, пероксиды типа H2O2, в которых степень окисления атома О равна -1);
- степени окисления типичных металлов (I,II,III группы главные подгруппы периодической системы Д. И. Менделеева, кроме бора) в их соединениях постоянны и численно равны номеру группы, т.е. +1, +2, +3, соответственно;
- алгебраическая сумма степеней окисления атомов в молекуле равна нулю, в сложном ионе - заряду иона.
Запишем вычисленные степени окисления над символами элементов в уравнении реакции:
Na2Se+4O3 + Cl2 0+ NaOH → Na2Se+6O4 + NaCl- + H2O
H2Mn6+O4 → HMn7+O4 + Mn4+O2+ H2 O
Для составления электронных уравнений выпишем атомы элементов, изменившие свои степени окисления, и укажем число электронов, отдаваемое или принимаемое атомами для осуществления такого изменения степеней окисления:
первая реакция:
Se+4 - 2 е = Se+6
Cl2 0+ 2е = 2 Cl-
вторая реакция:
Mn6+ + 2 е = Mn4+
Mn6+ - е = Mn7+
Атомы элементов Se.в первой реакции и Mn во второй реакции (а также и вещества, в состав которых они входят Na2SeO3 в первой реакции и H2MnO4 во второй реакции) являются восстановителями (отдают электроны) и участвуют в процессе окисления (процессе отдачи электронов).
Атомы элементов Cl в первой реакции и Mn во второй реакции (а также вещества, в состав которых они входят Cl2.в первой реакции и H2MnO4 во второй реакции) являются окислителями (принимают электроны) и участвуют в процессах восстановления (процессе присоединения электронов):
Суммарное число электронов, отдаваемых в ходе реакции частицами-восстановителями, и суммарное число электронов, принимаемых в ходе реакции частицами-окислителями должны быть равны друг другу. На этом основан один из методов расстановки коэффициентов в уравнениях окислительно-восстановительных реакций, называемый методом электронного баланса.
Для обеспечения указанного электронного равенства подберем множители к электронным уравнениям процессов окисления и восстановления, найдя наименьшее общее кратное для числа отданных и присоединенных электронов и поделив его на каждое из чисел.
Запишем полученные множители справа за чертой у каждого из уравнений:
Первая реакция:
Se+4 - 2 е = Se+6 1
Cl2 0+ 2е = 2 Cl- 1
Вторая реакция:
Mn6+ + 2 е = Mn4+ 1
Mn6+ - е = Mn7+ 2
Расстановку коэффициентов проведем в следующей последовательности:
перенесем полученные в электронном балансе множители в левую и правую части уравнения реакции к формулам соответствующих веществ;
уравняем атомы металлов;
уравняем кислотные остатки;
уравняем атомы водорода.
Итоговые коэффициенты в уравнениях данных реакций таковы:
Na2SeO3 + Cl2 + 2NaOH → Na2SeO4 + 2NaCl + H2O
3H2MnO4 → 2HMnO4 + MnO2+2 H2O
Для проверки их правильности просуммируем число атомов кислорода в левой и правой части уравнения:
5 = 5
12 = 12
Значит коэффициенты расставлены верно.
Для определения типа рассматриваемой окислительно-восстановительной реакции воспользуемся следующей классификацией:
- межмолекулярные окислительно-восстановительные реакции (атом-окислитель и атом-восстановитель входят в состав разных веществ);
- внутримолекулярные окислительно-восстановительные реакции (атом-окислитель и атом-восстановитель входят в состав одного и того же вещества, являясь атомами разных элементов);
- реакции диспропорционирования (атом-окислитель и атом-восстановитель являются атомами одного и того же элемента в промежуточной степени окисления).
Рассматриваемые в задаче окислительно-восстановительные реакции относятся к типам:
Первая - межмолекулярная, вторая - диспропорционирования.