
- •Теплотехника 190600 заоч.3курс октябрь 2013
- •Структура теста по теплотехнике
- •1.Основные понятия и определения
- •1.1.Рабочие тела, их свойства и характеристики.
- •1.2.Молекулярно-кинетическая теория газов
- •1.3. Универсальное уравнение состояния идеального газа
- •1.4. Смесь идеальных газов
- •Задачи тестов
- •1.5. Теплоемкость газа
- •Вопросы тестов
- •Задачи тестов
- •2. Первый закон термодинамики
- •2.1. Термодинамическая система и параметры её состояния
- •2.2. Внутренняя энергия
- •2.3. Теплота и работа
- •2.4. Первый закон термодинамики
- •Вопросы тестов
- •Задачи тестов
- •3.Термодинамические процессы с идеальным газом.
- •3.1. Метод исследования термодинамические процессов
- •3.2. Основные термодинамические процессы.
- •Изохорный процесс.
- •Изобарный процесс.
- •Изотермический процесс.
- •Адиабатный процесс.
- •Политропный процесс.
- •Вопросы тестов
- •4. Второй закон термодинамики
- •Вопросы тестов
- •5.Влажный воздух
- •Вопросы тестов
- •5.Влажный воздух (Смеси рабочих тел)
- •6.Водяной пар
- •Процесс парообразования в рv-диаграмме
- •Процесс парообразования в Тs -диаграмме
- •Процесс парообразования в hs -диаграмме
- •Вопросы тестов
- •6.Водяной пар (Фазовые переходы)
- •Де 3. Термодинамический анализ циклов теплотехнических устройств
- •3.1 Циклы поршневых двигателей внутреннего сгорания и газотурбинных установок
- •3.2. Циклы паросиловых установок Цикл Ренкина в pv-координатах
- •3.3. Циклы холодильных установок
- •3.4. Термодинамический анализ процессов в компрессорах
- •Теплопередача
- •6.Теплопроводность
- •6.1. Температурное поле. Уравнение теплопроводности
- •6.2. Стационарная теплопроводность через плоскую стенку
- •6.3. Стационарная теплопроводность через цилиндрическую стенку
- •Вопросы тестов
- •7. Конвективный теплообмен
- •Расчетные формулы конвективного теплообмена.
- •7.1. Продольное обтекание тонкой пластины.
- •7.2. Турбулентное течение теплоносителя внутри трубы.
- •Вопросы тестов
- •8. Теплообмен излучением
- •5.2. Теплообмен излучением системы тел в прозрачной среде
- •Вопросы тестов
- •9. Теплопередача
- •Вопросы тестов
- •10. Основы теплового расчета теплообменников
- •Вопросы тестов
- •Де 6. Топливо и основы горения
- •6.1. Характеристики твердого топлива
- •6.2 Характеристики жидкого и газообразного топлива
- •6.3. Основы теории горения топлива
- •6.4. Топочные устройства. Горелки. Форсунки
- •Де 7. Теплогенерирующие устройства
- •7.1. Устройство парового котла
- •7.2. Вспомогательное оборудование котельной установки
- •7.3. Расчет кпд, расхода топлива и полезно использованной в котле теплоты
- •7.4. Технологическая схема котельной установки
Изобарный процесс.
Уравнение этого процесса в pv - координатах имеет вид p = const, а график процесса (изобара) изображается в виде горизонтальной линии.
Из уравнения состояния
(3.1) следует
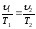 и
и
т. е. отношение удельных объёмов равно отношению температур.
Работа расширения газа при p =const в уравнении (3.3) равна
А
= р (v2
-
v1)  (3.9)
(3.9)
Воспользовавшись уравнением состояния (3.1), можно получить другую формулу для вычисления работы А= R (T2-T1) .
Отсюда следует физический смысл газовой постоянной, определяющий ее как работу, производимую 1кг газа при его изобарном нагреве на 1 градус.
Количество подведенной теплоты определяется уравнением
q
= cр
(Т2
-
Т1)  (3.10)
(3.10)
В Ts – координатах изобарный процесс изображается логарифмической кривой, но эта кривая более пологая по сравнению с изохорой (1-2´).

Изотермический процесс.
Уравнение этого процесса в Ts - координатах имеет вид T = const, а график процесса (изотерма) изображается в виде горизонтальной линии.
Из уравнения (3.2) следует ∆u= 0.
Тогда согласно первому закону термодинамики (3.6) q = A, т.е. вся подводимая к газу теплота расходуется на совершение работы расширения.
Из уравнения состояния
(3.1) следует
 , т.е. давление и удельный объём обратно
пропорциональны друг другу. Поэтому вpv
-координатах графиком изотермического
процесса (изотермой) является равнобокая
гипербола, для которой координатные
оси служат асимптотами.
, т.е. давление и удельный объём обратно
пропорциональны друг другу. Поэтому вpv
-координатах графиком изотермического
процесса (изотермой) является равнобокая
гипербола, для которой координатные
оси служат асимптотами.

Адиабатный процесс.
Адиабатным называется
процесс при отсутствии теплообмена
газа с внешней средой dq
= 0. По определению
энтропии ds
=
 , тогда иds
= 0, т.е. адиабатный
процесс одновременно ещё и изоэнтропийный.
График процесса (адиабата) в Ts
- координатах изображается в виде
вертикальной линии.
, тогда иds
= 0, т.е. адиабатный
процесс одновременно ещё и изоэнтропийный.
График процесса (адиабата) в Ts
- координатах изображается в виде
вертикальной линии.
По первому закону термодинамики (3.7) ∆u = - A, т.е. работа расширения совершается только за счёт уменьшения внутренней энергии.
Уравнение этого процесса в pv - координатах имеет вид pvк = const, (3.11)
где параметр k
=
 называется показателем адиабаты.
Поскольку cp
> cv,
то величина k
>
1. На рабочей pv
– диаграмме адиабата падает более круто
по сравнению с изотермой при увеличении
v.
называется показателем адиабаты.
Поскольку cp
> cv,
то величина k
>
1. На рабочей pv
– диаграмме адиабата падает более круто
по сравнению с изотермой при увеличении
v.
Работа газа в адиабатном процессе определена из первого закона термодинамики
A = сv (Т1-Т2). (3.12)


Политропный процесс.
Политропным называется
процесс, в котором удельная теплоёмкость
газа остаётся постоянной, т.е. c
= const. Уравнение политропного процесса
(политропы): 
pvn= const (3.16)
где
коэффициент n
=
 называется показателем политропы.
называется показателем политропы.
Теплоёмкость
в политропном процессе c
= cv

Политропный процесс есть обобщенный случай всех рассмотренных выше изопроцессов:
при n = 0 p = const – изобарный процесс;
при n = 1 pv = const – изотермический процесс;
при n = k pvк = const – адиабатный процесс;
при
n
=
 v
= const – изохорный процесс.
v
= const – изохорный процесс.
|
Процесс |
Изменение энтропии |
Количество теплоты |
Изменение внут- ренней энергии |
Работа процесса |
|
Δs |
q, |
Δu |
A | |
|
|
кДж/кг*К |
кДж/кг |
кДж/кг |
кДж/кг |
|
Изохорный v = const |
Δs12=cvln |
q12=Δu12 |
Δu12=cv(T2–T1) |
0 |
|
Изобарный p = const |
Δs12=cpln
|
q12=Δu12+A12 |
Δu12=cv(T2–T1) |
А12=R(T2–T1) |
|
Изотермический Т = const |
Δs12=Rln |
q12=A12 |
0 |
A12=RT3ln |
|
Адиабатный pvk = const |
0 |
0 |
Δu12=cv(T2–T1) |
А12= - ΔU12 |
|
Политропный pvn= const |
Δs12=cv |
q12=Δu12+A12 |
Δu12=cv(T2–T1) |
А12= |



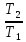
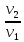

 ln
ln
