
- •Теплотехника 190600 заоч.3курс октябрь 2013
- •Структура теста по теплотехнике
- •1.Основные понятия и определения
- •1.1.Рабочие тела, их свойства и характеристики.
- •1.2.Молекулярно-кинетическая теория газов
- •1.3. Универсальное уравнение состояния идеального газа
- •1.4. Смесь идеальных газов
- •Задачи тестов
- •1.5. Теплоемкость газа
- •Вопросы тестов
- •Задачи тестов
- •2. Первый закон термодинамики
- •2.1. Термодинамическая система и параметры её состояния
- •2.2. Внутренняя энергия
- •2.3. Теплота и работа
- •2.4. Первый закон термодинамики
- •Вопросы тестов
- •Задачи тестов
- •3.Термодинамические процессы с идеальным газом.
- •3.1. Метод исследования термодинамические процессов
- •3.2. Основные термодинамические процессы.
- •Изохорный процесс.
- •Изобарный процесс.
- •Изотермический процесс.
- •Адиабатный процесс.
- •Политропный процесс.
- •Вопросы тестов
- •4. Второй закон термодинамики
- •Вопросы тестов
- •5.Влажный воздух
- •Вопросы тестов
- •5.Влажный воздух (Смеси рабочих тел)
- •6.Водяной пар
- •Процесс парообразования в рv-диаграмме
- •Процесс парообразования в Тs -диаграмме
- •Процесс парообразования в hs -диаграмме
- •Вопросы тестов
- •6.Водяной пар (Фазовые переходы)
- •Де 3. Термодинамический анализ циклов теплотехнических устройств
- •3.1 Циклы поршневых двигателей внутреннего сгорания и газотурбинных установок
- •3.2. Циклы паросиловых установок Цикл Ренкина в pv-координатах
- •3.3. Циклы холодильных установок
- •3.4. Термодинамический анализ процессов в компрессорах
- •Теплопередача
- •6.Теплопроводность
- •6.1. Температурное поле. Уравнение теплопроводности
- •6.2. Стационарная теплопроводность через плоскую стенку
- •6.3. Стационарная теплопроводность через цилиндрическую стенку
- •Вопросы тестов
- •7. Конвективный теплообмен
- •Расчетные формулы конвективного теплообмена.
- •7.1. Продольное обтекание тонкой пластины.
- •7.2. Турбулентное течение теплоносителя внутри трубы.
- •Вопросы тестов
- •8. Теплообмен излучением
- •5.2. Теплообмен излучением системы тел в прозрачной среде
- •Вопросы тестов
- •9. Теплопередача
- •Вопросы тестов
- •10. Основы теплового расчета теплообменников
- •Вопросы тестов
- •Де 6. Топливо и основы горения
- •6.1. Характеристики твердого топлива
- •6.2 Характеристики жидкого и газообразного топлива
- •6.3. Основы теории горения топлива
- •6.4. Топочные устройства. Горелки. Форсунки
- •Де 7. Теплогенерирующие устройства
- •7.1. Устройство парового котла
- •7.2. Вспомогательное оборудование котельной установки
- •7.3. Расчет кпд, расхода топлива и полезно использованной в котле теплоты
- •7.4. Технологическая схема котельной установки
1.2.Молекулярно-кинетическая теория газов
Молекулярно-кинетическая теория газов рассматривает идеальный газ:
а) молекулы не притягиваются и не отталкиваются;
б) молекулы взаимодействуют только при упругих столкновениях;
в) молекулы представляют собой материальные точки, т.е. обладают массой, но не имеют объёма.
В качестве критерия
идеальности газов принято считать
соотношение α/L 1,
где α
и L
соответственно линейные масштабы
молекул и расстояний между ними. Все
реальные газы при высоких температурах
и малых давлениях можно практически
считать как идеальные газы.
1,
где α
и L
соответственно линейные масштабы
молекул и расстояний между ними. Все
реальные газы при высоких температурах
и малых давлениях можно практически
считать как идеальные газы.
Давление – с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенку сосуда, в котором заключен газ.
Давление измеряется в паскалях по имени французского учёного и математика
Блеза
Паскаля (1623-1662).
1Па
= 1 . 1МПа
= 106Па.
. 1МПа
= 106Па.
Различают избыточное и абсолютное давление. Избыточное давление (Ри)– разность между давлением жидкости или газа и давлением окружающей среды.
Абсолютное давление (Р) – давление, отсчитываемое от абсолютного нуля давления или от абсолютного вакуума. Это давление является термодинамическим параметром состояния.
Температура – физическая величина, характеризующая интенсивность теплового движения молекул и пропорциональная средней кинетической энергии поступательного движения молекул.
Термодинамическая температура Т всегда положительна. При температуре абсолютного нуля (Т=0) тепловые движения прекращаются, и эта температура является началом отсчета абсолютной температуры.
Т = t
+ 273,15
 .
.
Ro
= 8,314
 -универсальная
газовая постоянная.
-универсальная
газовая постоянная.
Удельный
объем – отношение
объема вещества к его массе
 ,
,
 .
.
Абсолютное давление p, удельный объем v и абсолютная температура Т однозначно определяют термодинамическое состояние однофазного тела и называются термодинамическими параметрами состояния.
1.3. Универсальное уравнение состояния идеального газа
Уравнение состояния идеального газа Клапейрона – Менделеева:
 (1.1),
(1.1),
где р – давление, Па,
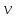 -
удельный
объем(отношение
объема вещества к его массе)
-
удельный
объем(отношение
объема вещества к его массе)
 ,
,
Rμ
= - газовая
постоянная данного газа,
- газовая
постоянная данного газа,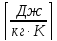 ,
,
Например,
для кислорода
 =
=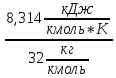 =
= .
(1.2)
.
(1.2)
Уравнение состояния содержит три параметра: давление, удельный объём и температуру. Два из них независимы, а третий определяется по уравнению (1.1).
Для
любого процесса 1-2:,
p1 v1=Rμ
v1=Rμ T1,
T1,
p2 v2=Rμ
v2=Rμ T2.
T2.
Разделив левую часть первого уравнения на левую часть второго уравнения, а правую часть первого уравнения на правую часть второго уравнения и сократив Rμ, получим:
 (1.3)
(1.3)
1.4. Смесь идеальных газов
Под газовой смесью понимается смесь отдельных газов, не вступающих между собой ни в какие химические реакции. Каждый газ (компонент) в смеси независимо от других газов полностью сохраняет все свои свойства и ведет себя так, как если бы он один занимал весь объем смеси.
Парциальное давление – это давление, которое имел бы каждый газ, входящий в состав смеси, если бы этот газ находился один в том же количестве, в том же объеме и при той же температуре, что и в смеси.
Закону Дальтона: Общее давление смеси газов равно сумме парциальных давлений отдельных газов, составляющих смесь.
рсм = р1 + р2 + р3 + . . .рn = ∑ рi , (1.4)
где р1 , р2 , р3 . . .рn – парциальные давления.
Состав
смеси задается долями объемными r,
r1
=
 ;r2
=
;r2
=
 ;
;
массовыми
g g1
=
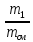 ;g2
=
;g2
=
 ;
.
;
.
и мольными r1′:
r1′
=
 ;r2′
=
;r2′
=
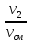 ;
.
;
.
где V1; V2; Vсм – объемы компонентов и смеси; m1; m2; mсм – массы компонентов и смеси; ν1; ν2; νсм – количество вещества (киломолей) компонентов и смеси.
Для идеального газа по закону Дальтона объёмные доли равны мольным:
Так как V1 +V2 = Vсм и m1 + m2 = mсм , то r1 + r2 = 1 , g1 + g2 = 1. .
Молярная
масса смеси:
μсм
= μ1
r1
+ μ2
r2.
μсм
=

где: μ1 , μ2, μсм – молярные массы компонентов и смеси.
Связь
между объемными и массовыми долями:
g1
= r1∙ ;g2
= r2∙
;g2
= r2∙ .
.
