
- •Лекция 3 кислотно-основное равновесие в растворах электролитов
- •3.1 Протолитическая теория кислот и оснований
- •3.2 Кислотно-основное равновесие
- •3.2.1 Типы протолитических реакций
- •2.2.2 Константа кислотности и основности. Расчеты рН
- •Расчет рН
- •Чистая вода
- •Механизм действия
- •3.4. Теория кислот и оснований Льюиса. Мягкие и жёсткие кислоты и основания.
Механизм действия
Сущность действия кислотно-основного буфера состоит в том, что отдельные компоненты буферного раствора связывают Н+ или ОН– , вводимых в них кислот или щелочей с образованием слабых электролитов.
![]()
![]()
Буферные системы:
а) Слабая кислота и соль этой кислоты
CH3COOH /CH3COONa – ацетатный буфер (рН=5)
к-та осн.
HCOOH /HCOONa – формиатный буфер (рН=2)
к-та осн.
Кислотная атака
![]()
Щелочная атака
![]()
б) Кислые соли слабой кислоты
NaH2PO4 /Na2HPO4 – фосфатный буфер (рН=8)
к-та осн.
Кислотная атака
![]()
Щелочная атака
![]()
в) Кислая и средняя соли слабой кислоты
NaHCO3 /Na2CO3 – гидрокарбонатный буфер
к-та осн.
Кислотная атака
![]()
Щелочная атака
![]()
г) Слабое основание и соль этого основания
NH4Cl /NH4OH – аммиачный буфер (рН=9)
к-та осн.
Кислотная атака
![]()
Щелочная атака
![]()
Буферные системы характеризуются двумя параметрами:
значением создаваемого рН
буферной ёмкостью
Значение рН в буферных системах определяется величиной констант ионизации слабой кислоты или слабого основания соответственно, а также в кислотных системах соотношением концентраций слабой кислоты и её соли; в основных системах – соотношением концентрации слабого основания и его соли. Равновесные состояния в буферных системах можно рассматривать как равновесие процесса ионизации соответствующих слабых кислот или оснований.
Значение рН буферного раствора остаётся неизменным и при разбавлении, поскольку отношение СНА / СА- не меняется. И лишь при очень большом разбавлении (в 104 раз и более) следует учесть автопротолиз воды: значение рН при этом может измениться на 0,5-1,0 единиц.
Буферная емкость. Очевидно, что добавлять сильную кислоту или основание к буферному раствору можно лишь в определенных пределах. Каждый буферный раствор характеризуется сопротивляемостью к изменениям. Количественно ее выражают буферной емкостью
![]()
Буферная емкость определяется числом молей эквивалентов сильной кислоты или основания, которые нужно добавить к 1 л буферного раствора, чтобы изменить рН раствора на единицу. Буферная емкость зависит от концентрации компонентов буферной смеси. Зная буферную емкость, можно найти изменение рН раствора при добавлении сильной кислоты или основания, определить состав буферной смеси.
В буферном растворе устанавливается равновесие:
![]()
![]()
В упрощенном виде
![]()
![]()
Так как равновесия сильно сдвинуты влево, то
[НА] = Ск-ты [А–] = Сосн.
![]()
![]()
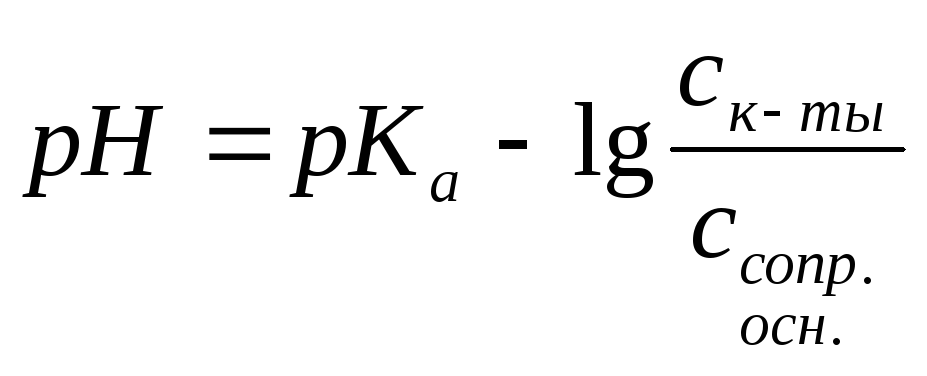
![]()
Пример 4. Вычислить рН 1 л буферного раствора, содержащего 0,1 моль уксусной кислоты и 0,1 моль натрия ацетата. Определить, насколько изменится рН раствора при добавлении
а) 0,01 моль соляной кислоты;
б) 0,01 моль натрия гидроксида
Кд(СН3СООН) = 1,75.10-5
а)

![]()
![]()
При добавлении кислоты
![]()
Сосн. = 0,1 – 0,01 = 0,09 моль/л
Ск-ты = 0,1 + 0,01 = 0,11 моль/л
![]()
![]()
Если к чистой воде добавить 0,01 моль соляной кислоты, то рН изменится с 7 до 2 (для сравнения).
б) при добавлении 0,01 моль NaOH
![]()
[СН3СООН] = 0,1 - 0,01= 0,09 моль/л
[СН3СОО‾] = 0,1 + 0,01 = 0,11 моль/л
![]()
![]()
При добавлении к чистой воде рН изменится от 7 до 12.
Буферные растворы организма
а) гидрокарбонатный буфер
H2CO3 /HCO3─
CO2 + H2O ←→ H2CO3 ←→ HCO3─ + H+
Основное назначение – нейтрализация кислот. Это основной буфер плазмы крови, система быстрого реагирования, т.к. углекислый газ быстро выводится через легкие. Этот буфер содержится также в эритроцитах, почечной ткани.
б) фосфатная буферная система
H2PO4─ /HPO42─
Вкислоты=1-2 ммоль/л
Воснования=0,5 ммоль/л
Функционирует, в основном, в плазме. Более консервативна,
т.к. избыточные продукты нейтрализации выводятся через почки.
в) гемоглобиновый буфер
HHb /Hb─ Ka=6,3.10-9
HHbO2/HbO2─ - оксигемоглобин; Ka= 1,12.10-7
Это главная буферная система эритроцитов (75% всей буферной емкости крови).
Механизм действия гемоглобинового буфера
Гемоглобин – слабая кислота
![]()
При кислотной атаке
![]()
При щелочной атаке
![]()
![]()
![]()
![]()
Многие буферные системы функционируют в организме совместно.
Смещение кислотно-основного равновесия в сторону повышения ионов водорода – ацидоз, в сторону гидроксид-ионов - алкалоз.
Для коррекции ацидоза вводят 4% раствор натрия гидрокарбоната; при алкалозе -5-15% раствор аскорбиновой кислоты.
Изменение рН на 0,4 приводит к летальному исходу.
Щелочной резерв крови определяется объемом СО2 в 100 мл крови (в норме 25-30 ммоль/л).
г) белковый буфер
Белки – амфотерные полиэлектролиты

Белок – основание белок – кислота
Механизм действия


