
- •Лекция 3 кислотно-основное равновесие в растворах электролитов
- •3.1 Протолитическая теория кислот и оснований
- •3.2 Кислотно-основное равновесие
- •3.2.1 Типы протолитических реакций
- •2.2.2 Константа кислотности и основности. Расчеты рН
- •Расчет рН
- •Чистая вода
- •Механизм действия
- •3.4. Теория кислот и оснований Льюиса. Мягкие и жёсткие кислоты и основания.
3.2 Кислотно-основное равновесие
3.2.1 Типы протолитических реакций
1. Реакции протолиза (ионизации).
К ним относятся реакции взаимодействия кислоты или основания с водой:
![]()
К-та 1 осн.2 к-та 2 осн.1
![]()
К-та 1 осн.2 к-та 2 осн. 1
2. Реакции автопротолиза, связанные с передачей протона от одной молекулы воды к другой.
![]()
Реакции гидролиза
CH3COONa+ H2O ←→ CH3COOH + NaOH
CH3COO- + H2O ←→ CH3COOH + OH-
осн.2 к-та 1 к-та 2 осн.1
Кислотно-основные реакции
NH3 + HCl → NH4+ + Cl-
осн.2 к-та 1 к-та 2 осн.1
С точки зрения аналитики выделяют следующие типы реакций:
1) с переносом протона – кислотно-основные;
2) с переносом электрона – ОВ реакции;
3) с переносом электронных пар с образованием связей по донорно-акцепторному механизму – реакции комплексообразования.
2.2.2 Константа кислотности и основности. Расчеты рН
Способность кислоты отдавать протон, а основания принимать его (т.е. силу кислот и оснований) можно охарактеризовать константами равновесий,
 HS
– растворитель
HS
– растворитель
которые называют константами кислотности (Ка) и основности (Кb).
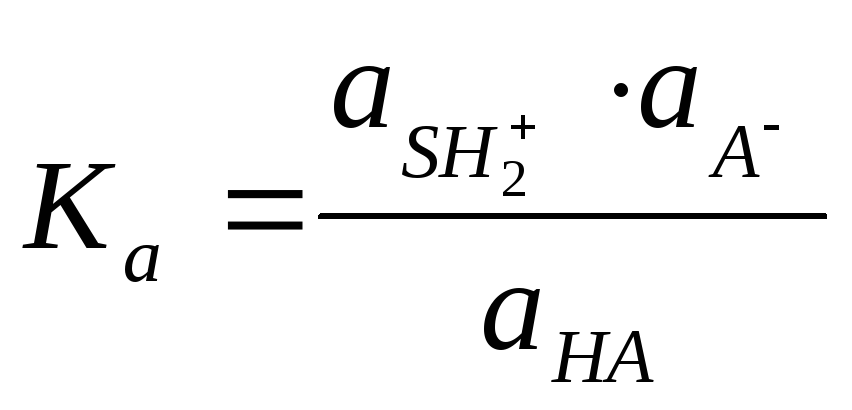
![]()
Активность растворителя – величина постоянная (табличные данные)
![]()
Положения кислотно-основных равновесий
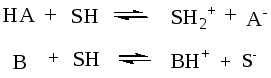
и величины соответствующих констант кислотности и основности зависят от природы растворителя.
Если растворитель – более сильный акцептор протонов, чем вода (например, аммиак), то в нем сила кислот возрастает. Так кислоты слабые в водных растворах могут быть сильными в аммиаке.
Чем сильнее основные свойства растворителя, тем больше кислот нивелируется в нем.
Аналогично, чем сильнее кислотные свойства растворителя, тем больше оснований нивелируется в нем.
При переходе от более к менее основному растворителю сильные кислоты могут быть слабыми (напр., HCl и HClO4 в воде – сильные кислоты , а в ледяной уксусной кислоте становятся слабыми).
Расчет рН
Расчеты кислотно-основных равновесий используют для:
1) нахождения рН раствора по известным равновесным концентрациям;
2) определения равновесных концентраций по известному значению рН
рН – важная оценка для биологических жидкостей.
Для живых организмов характерно поддержание кислотно-основного состояния на определенном уровне. Это находит выражение в достаточно постоянных значениях рН биологических сред и способности восстанавливать нормальные значения рН при воздействии протолитов.
Система, поддерживающая протолитический гомеостаз, включает в себя не только физиологические механизмы (легочную и почечную компенсации), но и физико-химическое действие, ионный обмен, диффузию.
В аналитической химии важно знать концентрации всех частиц в растворе кислоты или основания после установления равновесия, в частности концентрацию ионов Н+ (рН).
![]() -
слабый электролит
-
слабый электролит
![]() -
сильный электролит
-
сильный электролит
Чистая вода

![]()
![]()
![]()
![]()
![]()
![]()
![]()
Чистой воды не существует. Морская вода содержит почти все химические элементы.
Растворы слабых кислот
![]()
![]() Т.к.
Т.к. ![]() ,
то
,
то
![]()
Пример 1. Рассчитать рН 0,1М раствора уксусной кислоты.
![]()
![]()
![]() М
М
![]() или
или
![]()
Растворы слабых оснований
![]()
![]()
![]()
![]()
![]()
Пример 2. Рассчитать рН 0,1 М раствора аммония гидроксида.


![]()
![]()
![]() или
или
![]()
Растворы сильных кислот
![]()

Для учета влияния электростатического взаимодействия ионов введено понятие ионной силы раствора. Она зависит от концентрации иона и его заряда.
Для сильных электролитов закон действия масс выполняется, если пользуются активностями. Активность учитывает концентрацию реагентов, меж-ионное взаимодействие (ион-ионное, ион-дипольное, диполь-дипольное, водородные связи).
Согласно теории Дебая и Хюккеля
![]()
![]()
![]() - зависимость
коэффициента подвижности от ионной
силы
- зависимость
коэффициента подвижности от ионной
силы
А зависит от диэлектрической постоянной растворителя и температуры системы. При t=25°С А=0,512 и для бинарного электролита
![]()
Пример3. Рассчитать рН 0,1М р-ра НСl.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Растворы сильных оснований
Пример 4. Рассчитать рН 0,1 н. раствора натрия гидроксида.
![]()
![]()
![]()
![]()
![]()
![]()
3.3 Протолитическое равновесие в буферных растворах
В широком смысле буферными называют системы, поддерживающие определенное значение какого-либо параметра при изменении состава.
Буферные растворы могут быть кислотно-основными – поддерживают постоянное значение рН при введении кислот или оснований; окислительно-восстановительными – сохраняют постоянным потенциал системы при введении окислителей или восстановителей; известны металлобуферные растворы.
Буферный раствор представляет собой сопряженную пару; в частности, кислотно-основной буфер – сопряженную кислотно-основную пару:

