
- •Вопросы к экзамену по аналитической химии
- •I. Химия и медицина
- •1. Предмет, цели и задачи аналитической химии. Краткий исторический очерк развития аналитической химии. Место аналитической химии среди естественных наук и в системе медицинского образования.
- •II. Качественный анализ
- •2. Основные понятия аналитической химии. Типы аналитических реакций и реагентов. Требования, предъявляемые к анализу, чувствительности, селективности определения состава веществ.
- •3. Физико-химические и физические методы анализа. Макро-, полумикро-, микро- и ультрамикроанализ. Характеристика чувствительности аналитических реакций.
- •4. Аналитическая классификация катионов. Систематический и дробный анализ.
- •Общая характеристика группы
- •6. Систематический анализ смеси катионов I аналитической группы.
- •7. Применение закона действующих масс в аналитической химии. Основные положения теории слабых электролитов Аррениуса. Константа диссоциации, степень диссоциации. Закон разведения Оствальда.
- •Основные положения электролитической теории с. Аррениуса
- •Теория слабых электролитов
- •8. Основные положения теории сильных электролитов Дебая-Гюккеля. Ионная сила раствора. Активность и коэффициент активности.
- •9. Уравнения, применяемые к неидеальным (реальным) растворам. Термодинамическая константа ионизации.
- •Общая характеристика группы
- •12. Систематический анализ смеси катионов II аналитической группы.5
- •13. Протолитическая теория кислот и оснований. Понятие кислоты и основания. Амфолиты.
- •14. Кислотно-основное равновесие. Типы протолитических реакций.
- •15. Кислотные и основные свойства растворителей. Влияние природы растворителя на силу кислот и оснований. Константа кислотности и основности. Нивелирующее и дифференцирующее действие растворителей.
- •16. Диссоциация воды. Ионное произведение воды. Водородный показатель рН как количественная мера активной кислотности и щёлочности. Кислотно-основные индикаторы. Измерения рН растворов (см. 17).
- •19. Теория кислот и оснований Льюиса. Мягкие и жёсткие кислоты и основания.
- •Общая характеристика группы
- •21. Систематический анализ смеси катионов III аналитической группы.
- •22. Систематический анализ смеси катионов I-III аналитических групп.
- •25. Систематический анализ смеси катионов IV аналитической группы.
- •26. Гетерогенные процессы. Равновесие между жидкой и твердой фазами. Константа гетерогенных равновесий – константа растворимости (термодинамическая, реальная, условная).
- •28. Схема образования осадка. Свойства кристаллических и аморфных осадков. Влияние различных факторов на структуру и дисперсность осадков. Способы получения чистых осадков.
- •Реакции катионов железа (III)
- •Реакции катионов железа (II)
- •30. Систематический анализ смеси катионов V аналитической группы
- •31. Комплексные соединения, их строение и классификация. Хелатные и внутрикомплексные соединения.
- •Номенклатура комплексных соединений
- •Название некоторых комплексообразователей
- •32. Металлолигандное равновесие в водном растворе. Константа нестойкости и устойчивости комплексных соединений (полные, ступенчатые, координационные и истинные термодинамические).
- •33. Металлолигандный гомеостаз и способы его коррекции. Лигандообменные процессы в организме в норме и при патологии. Применение комплексных соединений в медицине.
- •34. VI аналитическая группа катионов. Общая характеристика катионов этой группы. Характерные и специфические реакции катионов.
- •Все осадки растворимы в минеральных кислотах, аммиаке и солях аммония
- •35. Систематический анализ смеси катионов VI аналитической группы.
- •36. Систематический анализ смеси катионов IV-VI аналитической группы.
- •Систематический ход анализа смеси катионов
- •Систематический ход анализа смеси катионов
- •IV аналитической группы
- •Систематический анализ смеси катионов VI аналитической группы
- •37. Аналитическая классификация анионов. Первая аналитическая группа анионов. Характерные и специфические реакции анионов so42ˉ, so32ˉ, co32ˉ, SiO32ˉ, s2o32ˉ, b4o72ˉ, po43ˉ.
- •Специфические реакции анионов I аналитической группы
- •Реакции тиосульфат-иона (s2o32‾)
- •38. Вторая аналитическая группа анионов. Характерные и специфические реакции анионов Clˉ, Brˉ, iˉ, scn ˉ, s2ˉ.
- •Реакции хлорид-иона (Cl‾)
- •Реакции иодид-иона (I‾)
- •Реакции роданид-иона (cns‾)
- •39. Третья аналитическая группа анионов. Характерные и специфические реакции анионов no3ˉ, no2ˉ, ch3cooˉ.
- •Реакция нитрат-иона (no3‾)
- •Реакции нитрит-иона (no2‾)
- •Реакции ацетат-иона (ch3coo‾)
- •III. Количественный анализ
- •40. Задачи и методы количественного анализа. Классификация методов количественного анализа. Сущность титриметрических методов анализа.
- •41. Способы выражения состава растворов: массовая доля, молярная концентрация, молярная концентрация эквивалента, моляльная концентрация, молярная доля, объёмная доля, титр.
- •42. Закон эквивалентов и его применение в количественном анализе. Способы определения точки эквивалентности. Способы приготовления рабочих растворов. Способы титрования: прямое, обратное, косвенное.
- •Классификация методов анализа по типу реакции
- •Классификация методов анализа по способу титрования
- •43. Сущность метода кислотно-основного титрования. Основные реакции и титранты метода. Ацидиметрия, алкалиметрия. Кислотно-основные индикаторы.
- •Титрование сильной кислоты сильной щелочью:
- •Титрование слабого основания сильной кислотой:
- •Титрование слабой кислоты сильной щелочью:
- •Кислотно-основные индикаторы
- •Кислотно-основные индикаторы
- •44. Кривые кислотно-основного титрования. Расчет, построение и анализ типичных кривых кислотно-основного титрования.
- •45. Окислительно-восстановительные реакции, применяемые в объёмном анализе. Сущность методов оксидиметрии. Классификация редокс-методов, способы установления точки эквивалентности в оксидиметрии.
- •Общая характеристика и классификации методов оксидиметрии
- •46. Метод перманганатометрии, его сущность.Условия проведения перманганатометрического титрования. Титрант, его приготовление и стандартизация. Определение солей железа (II) в растворах.
- •48. Иодометрическое определение меди в растворах. Применение иодометрии в медицине. Определение солей меди (II) в растворах.
- •49. Теоретические основы комплексонометрического титрования. Условия проведения комплексонометрического определения содержания металлов в растворе. Комплексоны, их особенности.
- •Классификация физико-химических методов
- •52. Спектрофотометрический метод. Его сущность. Основные законы светопоглощения – законы Бугера-Ламберта и Бера.
- •Классификация методов оптического анализа
- •55. Потенциометрический метод. Теоретические основы метода, классификация
- •Типы электродов, применяемых в потенциометрии:
- •Потенциометрическое определение рH растворов
- •57. Полярографический метод. Сущность полярографии. Индикаторные электроды и электроды сравнения. Диффузионный ток. Качественный и количественный полярографический анализ.
- •58. Хроматографические методы анализа. Ионообменная, газовая и жидкостная хроматография.
- •Классификация хроматографических методов
- •59. Экстракция. Сущность метода. Закон распределения. Константа экстракции. Коэффициент распределения.
- •60. Важнейшие растворители и реагенты, используемые в экстракции. Хелатные соединения в экстракции. Скорость экстракции. Примеры разделения биологических объёктов методом экстракции.
21. Систематический анализ смеси катионов III аналитической группы.
А нализируемый
раствор:
нализируемый
раствор:
Ca2+, Sr2+, Ba2+; Осадок: BaCrO4
п риливают
CH3COONa
риливают
CH3COONa
K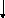 2Cr2O7;
центрифугируют
2Cr2O7;
центрифугируют

|
|
Центрифугат: Ca2+, Sr+
| ||
|---|---|---|---|
|
|
Приливают (NH4)2CO3;
О |
Из отдельной порции открывают Sr2+ гипсовой водой | |
|
|
| ||
|
Осадок стронция сульфата отбрасывают |
|
К |

-
В центрифугате открывают Ca2+ раствором (NH4)2C2O4
или раствором K4[Fe(CN)6]
22. Систематический анализ смеси катионов I-III аналитических групп.
|
|
А | |||
|---|---|---|---|---|
|
|
Из отдельной порции открывают NH4+ кипячением с NaOH |
Приливают HCl и центрифугируют | ||
|
|
| |||
|
|
| |||
|
Осадок: PbCl2, AgCl, Hg2Cl2 анализируют по схеме N 6 |
|
Осадок: BaSO4, SrSO4, PbSO4 переводят в карбонаты много- разовым кипячением с Na2CO3 |
|
Центрифугат 1: NH4+, Na+, K+ Ca2+, Sr2+, Ba2+, Pb2+ (в небольшом количестве) | |
|
Из отдельной пор ции открывают Pb2+ калия иодидом |
Приливают (NH4)2SO4 и центрифугируют |
|
Осадок: BaCO3, SrCO3, PbCO3 растворяют в уксусной кислоте |
|
Раствор: Ba2+, Sr2+, Pb2+ |
|
Для осаждения Pb2+ добавляют KI, осадок PbI2 отбрасывают |

|
Центрифугат 2: NH4+, Na+, K+ и в небольшом количестве Сa2+ |
|
Из отдельной порции центрифугата 2 открывают Сa2+ аммония оксалатом; центрифугируют |


|
Центрифуг 4: Ba2+, Sr2+ | |
|
Осаждают Ba2+ калия дихроматом в присутствии натрия ацетата; центрифугируют |
В центрифугате 5 открывают Sr2+ гипсовой водой |
23. Гидролиз как частный случай протолитических реакций. Константа и степень гидролиза. Расчет рН в растворах гидролизующихся солей. (cм. 236-240)
Гидролиз солей – это реакция ионного обмена между составными частями соли и воды, протекающая с изменением pH раствора.
Гидролиз солей является обратимым процессом; он рассматривается как частный случай химического равновесия, подчиняющегося закону действия масс. Обратной реакцией его является реакция нейтрализации.
Гидролиз: СН3СООNа + НОН ↔ CH3COOH + NaOH
Нейтрализация: СН3СОО - + НОН ↔ СН3СООН + ОН-
Суммарный эффект гидролиза определяется природой образующихся в растворе катионов и анионов. В зависимости от состава солей различают три вида реакций гидролиза:
1.Гидролиз солей, образованных катионами сильного основания и анионами слабой кислоты. (pH >7)
Кислород карбоксильной группы аниона, имеющий неподеленные пары электронов, вначале гидратируется, а затем образует ковалентную связь с протоном воды, и анион превращается в слабую уксусную кислоту, а в растворе накапливаются ионы гидроксила
Гидратация и ионизация СН3СОONa ↔ Nа+гидр + СН3СОО- гидр
Гидролиз: СН3СОО- гидр + НОН ↔ CH3COOH + ОН- гидр
Такой процесс называется гидролизом по аниону, так как анион вступает в реакцию обменного разложения воды и обусловливает накопление в растворе ионов гидроксила. Он продолжается до тех пор, пока в системе не установится равновесие между концентрацией неионизированных молекул уксусной кислоты и ее ионами.
Гидролиз солей, образованных катионами сильного основания и анионами многоосновной слабой кислоты, идет ступенчато, например:
СO32- + НОН ↔ НСО3- + ОН-
НСО3 + НОН ↔Н2СО3 + ОН-
Гидролиз солей фосфорной кислоты идет в три ступени:
РО43- + НОН ↔ НРО42-+ ОН-
HРО42- + НОН ↔ Н2РО4- + ОН-
Н2РО4- + НОН ↔ Н3РO4 + ОН-
Гидролиз по второй и третьей ступеням идет в незначительной степени или же только при создании определенных условий.
2. Гидролиз солей, образованных слабыми основаниями и анионами сильной кислоты (pH < 7), идет по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН- воды, образуя слабый электролит (основание).
NH4+ + H2O ↔ NH4ОН + H+
[Аl(ОН2)6]Сl3 + хH2O ↔ [Аl(ОН2)6]3+гидр + 3Сl-гидр
Гидратированные ионы Al3+ вступают в реакцию с молекулами H2O, образующ. вторичную гидратную оболочку. При этом H+ координированных молекул H2O испытывают отталкивающее действие одноименно заряженных ионов Al3+ и притяжение со стороны дипольных молекул воды вторичной гидратной оболочки.
3. Гидролиз солей, образованных катионами слабых оснований и анионами слабых кислот, идет по катиону и аниону, так как в этом виде реакции гидролиза происходит обменное разложение воды под действием как катиона, так и аниона. В результате образуются слабые основания и слабые кислоты.
NH4+ + CN- + H2O ↔ NH4ОН + HCN
4. Соли, образованные сильной кислотой и сильным основание, не гидролизуются, потому что катионы и анионы этих соли не связываются с ионами H+ и ОН- воды, т.е не образуют с ними слабых электролитов (рН=7)
Полному (необратимому) гидролизу подвергаются соли, которые образованы слабым нерастворимым основанием или слабой летучей или нерастворимой кислотой (прочерк в таблице).
Гидролиз соли, образованной слабым основанием и сильной кислотой:
NH4Cl+
H2O
![]() NH4OH
+ HCl
NH4OH
+ HCl
![]() + H2O
+ H2O
![]() NH4OH
+ H+
NH4OH
+ H+

Гидролиз соли, образованной слабой кислотой и сильным основанием:
CH3COONa
+ H2O
![]() CH3COOH
+ NaOH
CH3COOH
+ NaOH
CH3COO-
+ H2O
![]() CH3COOH
+ OH-
CH3COOH
+ OH-
![]()
Гидролиз соли, образованной слабым основанием и слабой кислотой:
CH3COONH4
+ H2O
![]() NH4OH
+ CH3COOH
NH4OH
+ CH3COOH
![]()
Способность соли к гидролизу характеризуется при помощи степени гидролиза (h):
![]()
![]()
Чем больше константа гидролиза, тем сильнее гидролизуется соль.
24. IV аналитическая группа катионов. Общая характеристика катионов этой группы. Специфические реакции катионов Al3+, Cr3+, Zn2+, Sn2+, Sn4+, As3+, As5+.
Реакции катиона алюминия (Al3+)
AlCl3 + 3 KOH → Al(OH)3↓ + 3 KCl AlCl3 + 4 NaOH → Na[Al(OH)4] + 3 NaCl
Al3+ + 3 OH‾ → Al(OH)3 Al3+ + 4 OH‾ → [Al(OH)4]‾
2. Ализарин С14Н5О2(ОН)2SО3Na в аммиачной среде образует нерастворимое в воде и уксусной кислоте соединение "алюминиевый лак", обладающее характерной оранжево-красной (яркой малиновой) окраской.
пробирочный метод: к 1-2 каплям раствора K4[Fe(CN)6] добавляют 1-2 капли раствора соли алюминия, 1-2 капли раствора аммиака и 2-3 капли ализарина. Наблюдают красную окраску «алюминиевого лака».
2 AlCl3 + 3 Na2CO3 + 3 H2O → 2 Al(OH)3↓ + 6 NaCl + 3 CO2↑
2 Al3+ + 3 CO32‾ + 3 H2O → 2 Al(OH)3 + 3 CO2
Реакции катиона хрома (Cr3+)
Cr(NO3)3 + 3 NaOH → Cr(OH)3↓ + 3 NaNO3 Cr(OH)3 + 3 NaOH → Na3[Cr(OH)6]
Cr3+ + 3 OH‾ → Cr(OH)3 Cr(OH)3 + 3 OH‾ → [Cr(OH)6]3‾
К 4-5 каплям раствора соли хрома приливают небольшой избыток едкой щелочи, 1-2 капли водорода пероксида и в течение 1-2 мин. нагревают до кипения, после чего его фильтруют. Фильтрат приобретает желтый цвет (обусловлен окраской аниона CrO42‾):
CrCl3 + 6 KOH → K3[Cr(OH)6] + 3 KCl
Cr3+ + 6 OH‾→ [Cr(OH)6]3‾
2 K3[Cr(OН)6] + 3 H2O2 → 2 K2CrO4 + 8 H2O + 2 KOH
Cr2(SO4)3 + 3 Na2CO3 + 3 H2O → 2 Cr(OH)3↓ + 3 Na2SO4 + 3 CO2↑
2 Cr3+ + 3 CO32‾ + 3 H2O → 2 Cr(OH)3 + 3 CO2
CrCl3 + 2 Na2HPO4 → CrPO4↓ + 3 NaCl + NaH2PO4
Cr3+ + 2 HPO42‾ → CrPO4 + H2PO4‾
Реакции катиона цинка (Zn2+)
3 ZnCl2 + 2 K4[Fe(CN)6] → Zn3K2[Fe(CN)6]2↓ + 6 KCl
3 Zn2+ + 2 K+ + 2 [Fe(CN)6]4‾ → Zn3K2[Fe(CN)6]2↓
3 ZnCl2 + 2 K3[Fe(CN)6] → Zn3[Fe(CN)6]2↓ + 6 KCl
3 Zn2+ + 2 [Fe(CN)6]3‾ → Zn3[Fe(CN)6]2↓
2(NH4)2[Hg(SNC)4] + ZnSO4 + CuSO4 → ZnCu[Hg(SNC)4]2↓+ 2 (NH4)2SO4
осадок тетрароданомеркуратов меди и цинка
2 [Hg(SNC)4]2‾ + Zn2+ + Cu2+ → ZnCu[Hg(SNC)4]2
оливково-зеленый
2 (NH4)2[Hg(SNC)4] + ZnCl2 + CoCl2 → ZnCo[Hg(SNC)4]2↓ + 4 NH4Cl
фиолетово-голубой
2 [Hg(SNC)4]2‾ + Zn2+ + Cо2+ → ZnCo[Hg(SNC)4]2
2 ZnCl2 + 2 Na2CO3 + H2O → (ZnOH)2CO3↓ + 4 NaCl + CO2↑
2 Zn2+ + 2 CO3 2-+ H2O → (ZnOH)2CO3↓ + CO2↑
Реакции катиона олова (Sn2+)
SnCl2 + 4 KOH → K2[Sn(OH)4] + 2 KCl
Sn2+ + 4 OH‾ → [Sn(OH)4]2‾
2 Bi(NO3)3 + 3 K2[Sn(OH)4] + 6 KOH → 2 Bi↓ + 3 K2[Sn(OH)6] + 6 KNO3
2 Bi3+ + 3 [Sn(OH)4]2‾ + 6 OH‾ → 2 Bi + 3 [Sn(OH)6]2‾
бархатисто-черный
HgCl2 + K2[Sn(OH)4] + 2 KOH → Hg↓ + K2[Sn(OH)6] + 2 KCl
Hg2+ + [Sn(OH)4]2‾ + 2 OH‾ → Hg + [Sn(OH)6]2‾
темно-серый
а) пробирочный метод: к 3-5 каплям раствора соли Sn2+ приливают 1-2-кратный избыток едкой щелочи и фильтруют в раствор соли Bi3+ или Hg2+. Наблюдают выпадение осадков.
Sn(OH)2 + 2 KOH → K2[Sn(OH)4]
Sn(OH)2 + 2 OH‾ → [Sn(OH)4]2-
2 SnCl2 + K4[Fe(CN)6] + 4 H2O → 2 Sn(OH)2↓ + H4[Fe(CN)6] + 4 KCl
Sn2+ + 2 H2O → Sn(OH)2 + 2 H+
3 SnCl2 + 2 K3[Fe(CN)6] + 6 H2O → 3 Sn(OH)2↓ + 2 H3[Fe(CN)6] + 6 KCl
Sn2+ + 2 H2O → Sn(OH)2 + 2 H+
SnCl4 + 4 NaNO3 + 4 H2O → Sn(OH)4↓ + 4 HNO3 + 4 NaCl
Sn4+ + 4 H2O → Sn(OH)4 + 4 Н+
Sn(NO3)2 + MoO3 + 2 HNO3 → Sn(NO3)4 + MoO2 ↓+ H2O
Sn2+ + MoO3 + 2 H+ → Sn4+ + MoO2 + H2O
SnCl2 + Na2CO3 + H2O → Sn(OH)2↓ + 2 NaCl + CO2↑
Sn2+ + CO32‾ + H2O → Sn(OH)2 + CO2

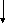 садок:
МеСО3
растворяют
в уксусной кислоте
садок:
МеСО3
растворяют
в уксусной кислоте раствору ацетатов стронция и кальция
приливают (NH4)2SO4;
центрифугируют
раствору ацетатов стронция и кальция
приливают (NH4)2SO4;
центрифугируют


 нализируемый
раствор
нализируемый
раствор