- •1. Переваривание и всасывание нуклеопротеидов
- •2. Метаболизм пуриновых и пиримидиновых нуклеотидов
- •Катаболизм пуриновых нуклеотидов
- •Реакции распада мочевой кислоты. От нуклеотидов к основаниям.
- •Катаболизм пиримидиновых нуклеотидов
- •Продукты распада нуклеотидов могут повторно использоваться (реутилизацироваться)
- •De novoсинтез пуриновых и пиримидиновых рибонуклеотидов
- •De Novoсинтез пуриновых нуклеотидов.
- •Регуляция синтеза пуриновых нуклеотидов denovo
- •Cинтез пиримидиновых нуклеотидов de novo
- •Рибонуклеотидредуктаза и биосинтез дезоксирибонуклеотидов
- •Регуляция активности рибонуклеотид редуктазы
- •Биосинтез тимидиловых дезоксирибонуклеотидов
- •Обмен дезоксиуридиловых нуклеотидов
- •Наиболее частые проявления нарушений обмена пуринов - гиперурикемия и подагра
- •Нарушение обмена пиримидиновых нуклеотидов также приводит к болезням.
- •Биосинтез днк – один из важнейших процессов передачи генетической информации последующим поколениям и ее хранения.
- •Ретровирусы внесли изменения в центральную догму молекулярной биологии.
- •Выход из состояния пролиферативного покоя требует специальных регуляторов.
- •У эукариот свой набор днк полимераз
- •Механизм синтеза рнк во многом напоминает синтез днк
- •Транскриптон (оперон) - единица транскрипции.
- •Промоторы имеют сходное строение
- •У эукариот – 3 рнк- полимеразы
- •Транскриптон (оперон) - единица транскрипции.
- •Промоторы имеют сходное строение
- •У эукариот – 3 рнк- полимеразы
- •В транскрипции у прокариот важная роль принадлежит -фактору
- •У эукариот молекула рнк модифицируется после транскрипции.
- •Кэпирование и полиаденилирование иРнКопределяют дальнейшие особенности функций иРнк
- •Сплайсинг – способ создания многообразия белков
De novoсинтез пуриновых и пиримидиновых рибонуклеотидов
Н есмотря
на возможность повторного использования
продуктов распада нуклеиновых кислот
для синтеза нуклеотидов, значительная
доля потребности клеток в нуклеотидах
удовлетворяется синтезом нуклеотидовde
novo.
Этот процесс использует достаточно
легко доступные компоненты.
есмотря
на возможность повторного использования
продуктов распада нуклеиновых кислот
для синтеза нуклеотидов, значительная
доля потребности клеток в нуклеотидах
удовлетворяется синтезом нуклеотидовde
novo.
Этот процесс использует достаточно
легко доступные компоненты.
ФРПФ. Необходимой предпосылкой для биосинтеза нуклеотидов является синтез активной формы рибоза-5-фосфата. Рибоза 5-фосфат вступает в реакцию с ATФ, формируя 5-фосфо - - D-рибозил-1-пирофосфат (ФРПФ).
Реакция катализируется синтетазой ФРПФ. Фермент обнаружен практически во всех тканях, потому, что ФРПФ служит субстратом для процессов реутилизации нуклеотидов, синтеза пиримидиновых нуклеотидов, и коферментов НАД+ и НАДФ+ (фермент фосфорибозил трансфераза), синтеза пуриновых нуклеотидов (ФРПФ амидотрансфераза) de novo.
Ф РПФ
синтетаза тщательно регулируется
рядом соединений (нуклеозидди- и
трифосфаты,
РПФ
синтетаза тщательно регулируется
рядом соединений (нуклеозидди- и
трифосфаты,
2 ,3-ДФГ),
преимущественно обеспечивая соответствие
синтеза ФРПФ потребности
,3-ДФГ),
преимущественно обеспечивая соответствие
синтеза ФРПФ потребности
De Novoсинтез пуриновых нуклеотидов.
Пуриновые основания собираются на рибозе при участии нескольких амидотрансферазных и трансформилирующих реакции. Весь процесс можно разделить на 2 этапа:
а) образование ИМФ - исходного предшественника для синтеза главных пуриновых нуклеотидов
б) преобразование ИМФ в АМФ и ГМФ.
Для синтеза ИМФ необходимо пять молей ATФ, два моля глутамина (атомы 3,9), один моль глицина (атомы 4,5,7) , один мольCO2(атом 6), один моль аспартата(атом 1) и два моля формиата (атомы 2,8). Формильный фрагмент переносится при участии тетрагидрофолиевой кислоты (ТГФ) в формеN5,N10-метенил-ТГФ иN10-формил-ТГФ (см рис 9-14).
К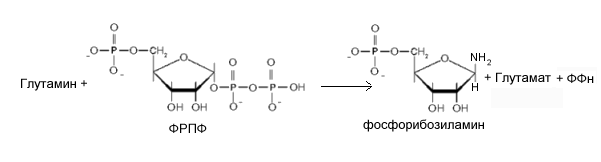 лючевая
реакция.
Биосинтез
пуриновых нуклеотидов происходит
активно в цитозоле печени, где присутствуют
все необходимые ферменты в форме
макромолекулярного агрегата. Первый
шаг - замена пирофосфата ФРПФ амидной
группой глутамина катализируется
фосфорибозипирофосфат амидотрансферазой.
лючевая
реакция.
Биосинтез
пуриновых нуклеотидов происходит
активно в цитозоле печени, где присутствуют
все необходимые ферменты в форме
макромолекулярного агрегата. Первый
шаг - замена пирофосфата ФРПФ амидной
группой глутамина катализируется
фосфорибозипирофосфат амидотрансферазой.
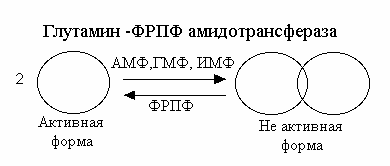
Продукт этой реакции - 5-фосфорибозиламин (ФРА). Аминогруппа глутамина, перенесенная на С1 рибоза-1-фосфата становится атомом N 9 будущего кольца пурина. Это - ключевая и ограничивающая скорость реакция пути синтеза пуриновых нуклеотидов.
Фермент находится под жестким аллостерическим контролем путем торможения по типу обратной связи. И AMФ, и ГМФ, и ИМФ порознь ингибируют активность амидотрансферазы, так же как и пары AMФ + ГМФ или AMФ + ИМФ. Этим обеспечивается тонкий постоянный контроль активности этого фермента. Нуклеотиды ингибируют фермент, способствуя агрегации небольших активных молекул в неактивные агрегаты молекул.
Коцентрация ФРПФ также играет существенную роль в регуляции скорости ключевой реакции. Нормальные внутриклеточные концентрации ФРПФ (которые могут и колебаться) - ниже Км фермента для ФРПФ, что создает возможности для увеличения скорости реакции, путем увеличения концентрации субстрата. Исследование зависимости скорости реакции от концентрации ФРПФ описывается S-образной кривой.
|
|
|
. Основные регуляторы активности глутамин-ФРПФ амидотрансферазы |
 Фермент
мало чувствителен к изменениям
концентрации глутамина, (кинетика
гиперболическая, а концентрация
глутамина соответсвует Км). Очень
высокая концен
Фермент
мало чувствителен к изменениям
концентрации глутамина, (кинетика
гиперболическая, а концентрация
глутамина соответсвует Км). Очень
высокая концен
. Реакции образования ИМФ- первого пуринового нуклеотида.
трация ФРПФ может снимать обычный ингибирующий эффект, вызываемый нуклеотидами, заставляя неактивные агрегаты фермента диссоциировать с образованием активных молекул. Скорость синтеза ФРПФ зависит от наличия субстратов синтеза (рибоза-5-фосфата) и каталитической активности ФРПФ-синтазы, активность которой в свою очередь зависит от концентрации мононуклеотидов , выступающих в роли аллостерических регуляторов
C интез
пуринов de
novo
- сложный, многоступенчатый, потребляющий
большое количество энергии и тщательно
регулируемый путь После образования
5-фосфорибозиламина, остальная часть
молекулы формируется серией реакций в
форме присоединения химических групп,
образуя сначала пяти - а затем шестичленное
кольца пурина. Целая молекула глицина
(реакция 1), за счет ATФ
присоединяется к аминогруппе ФРА,
образуя глицинамид рибозидфосфат (ГАР).
Эту реакцию катализирует
глицинамид-киносинтетаза.. Углеродные
атомы глицина становятся атомами С4 и
С5, а C
интез
пуринов de
novo
- сложный, многоступенчатый, потребляющий
большое количество энергии и тщательно
регулируемый путь После образования
5-фосфорибозиламина, остальная часть
молекулы формируется серией реакций в
форме присоединения химических групп,
образуя сначала пяти - а затем шестичленное
кольца пурина. Целая молекула глицина
(реакция 1), за счет ATФ
присоединяется к аминогруппе ФРА,
образуя глицинамид рибозидфосфат (ГАР).
Эту реакцию катализирует
глицинамид-киносинтетаза.. Углеродные
атомы глицина становятся атомами С4 и
С5, а C интез
пуринов de
novo
- сложный, многоступенчатый, потребляющий
большое количество энергии и тщательно
регулируемый путь После образования
5-фосфорибозиламина, остальная часть
молекулы формируется серией реакций в
форме присоединения химических групп,
образуя сначала пяти - а затем шестичленное
кольца пурина. Целая молекула глицина
(реакция 1), за счет ATФ
присоединяется к аминогруппе ФРА,
образуя глицинамид рибозидфосфат (ГАР).
Эту реакцию катализирует
глицинамид-киносинтетаза.. Углеродные
атомы глицина становятся атомами С4 и
С5, а
интез
пуринов de
novo
- сложный, многоступенчатый, потребляющий
большое количество энергии и тщательно
регулируемый путь После образования
5-фосфорибозиламина, остальная часть
молекулы формируется серией реакций в
форме присоединения химических групп,
образуя сначала пяти - а затем шестичленное
кольца пурина. Целая молекула глицина
(реакция 1), за счет ATФ
присоединяется к аминогруппе ФРА,
образуя глицинамид рибозидфосфат (ГАР).
Эту реакцию катализирует
глицинамид-киносинтетаза.. Углеродные
атомы глицина становятся атомами С4 и
С5, а
Реакции образования АМФ и ГМФ из ИМФ
атом азота - N7 кольца пурина. Этот атом азота формилируется при участии глицинамид-рибозилфосфат –формилтрансферазы.(реакция 2). Донором формильной группы является N5, N10 метенилтетрагидрофолат. Атом углерода этой группы займет положение С8 в кольце пурина. Вторая молекула глутамина участвует в реакции 3. Амидирование происходит по атому С4 формилглицинамид - рибозилфосфата и катализируется формилглицинамид рибозилфосфатсинтетазой. Присоединяемый атом азота займет положение N3. Замыкание пятичленного (имидазольного) кольца происходит в реакции 4 под вли аминоимидазолилрибозилфосфатсинтетазы. Аминоимидазолрибозилфосфат карбоксилируется (реакция 5) с образованием аминоимидазолкарбоксилат-рибозилфосфата.
-Аминогруппа аспарагиновой кислоты в следующей реакции (реакция 6) становится донором азота кольца в положении N1.Сукцинильный фрагмент аспарагиновой кислоты удаляется в форме фумаровой кислоты. В результате возникает аминоимидазолкарбоксиламид – рибозилфосфат, который формилируется (реакция 7) N10-формилтетрагидрофолатом под влиянием формилтрансферазы. Вновь присоединенный атом углерода займет в молекуле пурина положение 2. ИМФ-циклогидролаза (реакция 8) завершает формирование пуринового нуклеотида, катализируя замыкание 6-членного кольца пурина. В результате образуется первый пуриновый нуклеотид – инозиновая кислота, (инозинмонофосфат ИМФ). На образование ИМФ расходуется 4 моля АТФ.
О бразованиеAMФ
и ГМФ (рис.9-19).
ИМФ может
затем превратится или в AMФ
или в ГМФ. Образование ГМФ протекает в
2 стадии. Вначале ИМФ окисляется
бразованиеAMФ
и ГМФ (рис.9-19).
ИМФ может
затем превратится или в AMФ
или в ГМФ. Образование ГМФ протекает в
2 стадии. Вначале ИМФ окисляется
Рис. 9.20.Основные принципы регуляции синтеза пуриновых нуклеотидов.
при участии НАД зависимой ИМФ дегидрогеназы с образованием ксантинмонофосфата (КсMP). Последний во второй стадии аминируется при участии амидогруппы глутамина, используя молекулу АТФ. При этом АТФ гидролизуется до АМФ и ФФн . Атом кислорода в позиции 2 замещается амидной группой глутамина.
Образование АМФ также протекает в 2 стадии. ИМФ вначале аминируется с участием аспарагиновой кислоты. Механизм аминирования подобен реакции биосинтеза пуринового нуклеотида, в которой альфа аминогруппа аспарагиновой кислоты формирует атом N1 пуринового кольца. Аминирование ИМФ сопровождается образованием промежуточного соединения аденилосукцината. На втором этапе аденилосукцинат теряет атомы углерода аспарагиновой кислоты в составе фумарата, аминогруппа аспарагиновой кислоты становится 6-аминогруппой кольца аденина.