
- •Методические указания и контрольные задания
- •220114 Г. Минск, Староборисовский тракт 8, к.2
- •Общие методические указания
- •Методические указания
- •Тема 1.2 Динамика материальной точки и абсолютно твердого тела
- •Тема 1.3 Работа и энергия. Законы сохранения
- •Тема 1.4 Вращательное движение
- •Примеры решения задач
- •Раздел 2. Основы молекулярной физики и термодинамики
- •Тема 2.1 Физические основы молекулярно- кинетической теории
- •Тема 2.2 Физические основы термодинамики
- •Тема 2.3 Второе начало термодинамики
- •Тема 2.4 Структура и свойства твердых тел
- •Примеры решения задач
- •Раздел 3. Электричество ([1], т.2, ч.1 и т.3, ч.3)
- •Тема 3.1 Электростатика. Электрическое поле в вакууме
- •, Или .
- •Тема 3.2 Проводники в электрическом поле
- •Тема 3.3 Электрическое поле в диэлектриках
- •Тема 3.4 Энергия электрического поля
- •2. Электроемкость
- •Решение
- •3. Движение заряженных частиц в электрическом поле
- •4. Постоянный электрический ток
- •Контрольная работа №1
- •Литература Основная
- •Дополнительная
- •Справочные материалы
Тема 2.2 Физические основы термодинамики
Работа, совершаемая идеальным газом в различных процессах. Внутренняя энергия системы как функция состояния.
Работа и теплопередача. Количество теплоты. Эквивалентность количества теплоты и работы.
Прочитать §81, 82, 83.
Первое начало термодинамики и его применение к изопроцессам. Уравнения и графики этих процессов. Теплоемкость идеальных газов в зависимости от процесса.
Адиабатический процесс. Уравнение Пуассона.
Прочитать §88, 90.
Дополнение. Уместно сразу дать определение мольной (или молярной) теплоемкости.
![]() это
скалярная физическая величина, равная
тому количеству теплоты, которое
необходимо сообщить одному молю вещества
или газу, чтобы повысить его температуру
на один градус (или отвести это количество
теплоты, чтобы понизить его температуру
на один градус), т.е.
это
скалярная физическая величина, равная
тому количеству теплоты, которое
необходимо сообщить одному молю вещества
или газу, чтобы повысить его температуру
на один градус (или отвести это количество
теплоты, чтобы понизить его температуру
на один градус), т.е.
![]() ,
(4)
,
(4)
где
![]() число
молей;
число
молей;
![]() количество
теплоты, переданное
количество
теплоты, переданное
![]() молям вещества для нагревания на
молям вещества для нагревания на![]() градусов.
градусов.
Из первого начала термодинамики
![]() .
.
После почленного
деления на
![]() ,
получим, с учетом (4):
,
получим, с учетом (4):
![]()
и так как
![]() (где
(где![]() число
степеней свободы), то
число
степеней свободы), то
![]() .
(5)
.
(5)
Откуда хорошо
видно, что мольная теплоемкость газов
зависит не только от его рода (![]() ),
но и от процесса, в котором он участвует.
Так, например, при
),
но и от процесса, в котором он участвует.
Так, например, при![]() (изобарный процесс)
(изобарный процесс)
![]()
и тогда
![]() или
или
![]() (уравнение Майера),
(уравнение Майера),
где
![]() мольная
теплоемкость газа при постоянном объеме.
мольная
теплоемкость газа при постоянном объеме.
Тема 2.3 Второе начало термодинамики
Круговые, обратимые и необратимые процессы. Принцип действия тепловой и холодильной машин. Идеальная тепловая машина Карно и ее КПД.
Прочитать §81, 104 (формулы с энтропией опустить), §106.
Тема 2.4 Структура и свойства твердых тел
Кристаллические и аморфные тела. Кристаллическая решетка. Понятие о характере теплового движения в твердых телах. Теплоемкость и теплопроводность твердых тел. Закон Дюлонга и Пти.
Ознакомиться (§110, 114).
Примеры решения задач
Задача 2.1
В баллоне объемом
![]() л
находится гелий под давлением
л
находится гелий под давлением![]() МПа
и при температуре
МПа
и при температуре![]() К.
После того, как из баллона выпустили
К.
После того, как из баллона выпустили![]() г
гелия, температура в баллоне понизилась
до
г
гелия, температура в баллоне понизилась
до![]() К.
Определить давление
К.
Определить давление![]() гелия, оставшегося в баллоне.
гелия, оставшегося в баллоне.
|
Д а н о: С И
|
Р е ш е н и е |
|
|
Для решения задачи воспользуемся уравнением Менделеева-Клапейрона, применив его к конечному состоянию газа:
где
Из уравнения (1)
выразим искомое давление
|
|
|
Массу гелия
![]() выразим через массу
выразим через массу![]() ,
соответствующей начальному состоянию,
и массу гелия
,
соответствующей начальному состоянию,
и массу гелия![]() ,
выпущенного из баллона
,
выпущенного из баллона
![]() .
(3)
.
(3)
Массу гелия
![]() найдем также из уравнения
Менделеева-Клапейрона, применив его к
начальному состоянию
найдем также из уравнения
Менделеева-Клапейрона, применив его к
начальному состоянию
![]() .
(4)
.
(4)
Подставляя в
выражение (3) массу
![]() по формуле (4), а затем полученное выражение
по формуле (4), а затем полученное выражение![]() в формулу (2), найдем
в формулу (2), найдем
![]() ,
,
или после преобразования и сокращения
![]() .
.
Проверка наименования размерности, полученного результата:
![]()
![]() .
.
Вычисление:
![]()
![]()
![]() МПа.
МПа.
О т в е т:
![]()
![]() МПа.
МПа.
Задача 2.2
Баллон содержит
![]() г
кислорода и
г
кислорода и![]() г
аргона. Давление смеси
г
аргона. Давление смеси![]() МПа,
температура
МПа,
температура![]() К.
Принимая данные газы за идеальные,
определить емкость
К.
Принимая данные газы за идеальные,
определить емкость![]() баллона и плотность
баллона и плотность![]() смеси.
смеси.
|
Д а н о: С И
|
Р е ш е н и е |
|
|
В соответствии с законом Дальтона: давление смеси газов, не вступающих в химическую реакцию между собой, равно сумме парциальных давлений газов, входящих в состав смеси. Парциальным давлением газа называется давление, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
Из уравнения
Менделеева-Клапейрона парциальные
давления кислорода
|
|
|
![]() и
и
![]() .
.
Следовательно, по закону Дальтона, давление смеси газов
![]() или
или
![]() ,
,
откуда емкость баллона равна:
![]() .
(1)
.
(1)
Проверим единицу размерности полученного результата:
![]() .
.
.
После подстановки
числовых значений в формулу (1) и произведя
вычисления, получим
![]()
![]() .
.
Плотность смеси, с учетом (1), равна:
 .
(2)
.
(2)
После проверки
единицы размерности и произведя
вычисления, найдем, что
![]()
![]() .
.
О т в е т:
![]()
![]() ,
,![]()
![]() .
.
Задача 2.3
Вычислить удельные теплоемкости при
постоянном объеме
![]() и при постоянном давлении
и при постоянном давлении![]() неона и водорода, принимая эти газы за
идеальные.
неона и водорода, принимая эти газы за
идеальные.
|
Д а н о: С И
|
Р е ш е н и е |
|
|
Удельные теплоемкости идеальных газов выражаются формулами:
где
|
|
|
Подставляя числовые значения (1) и (2), получим:
а) для неона:
![]()
![]() ;
;
![]()
![]() ;
;
б) для водорода:
![]()
![]() ;
;
![]()
![]() ;
;
О т в е т: для неона:
![]()
![]() ,
,![]()
![]() ;
;
для водорода:
![]()
![]() ,
,![]()
![]() .
.
Задача 2.4
Кислород массой
![]() кг
занимает объем
кг
занимает объем![]()
![]() и находится под давлением
и находится под давлением![]() МПа.
Газ был нагрет сначала при постоянном
давлении до объема
МПа.
Газ был нагрет сначала при постоянном
давлении до объема![]()
![]() ,
а затем при постоянном объеме до давления
,
а затем при постоянном объеме до давления![]() МПа.
Найти изменение
МПа.
Найти изменение![]() внутренней энергии газа, совершенную
им работу
внутренней энергии газа, совершенную
им работу![]() и теплоту
и теплоту![]() ,
переданную газу. Построить график
процесса.
,
переданную газу. Построить график
процесса.
|
Д а н о: С И
|
Р е ш е н и е |
|
|
Изменение внутренней энергии газа выражается формулой:
где
Начальную и конечную температуру газа найдем, используя уравнение Клапейрона-Менделеева:
Решая его
относительно
|
|
|
![]() .
(3)
.
(3)

Рис. 2.1
Проверим единицу
размерности
![]() :
:
![]() .
.
Выполним расчет температур по формуле (3) для трех точек (1, 2, 3), приведенных на рис. 2.1:
![]() К;
К;
![]() К;
К;
![]() К.
К.
Подставляя в выражение (1) числовые значения, входящих в него величин, и выполняя арифметические действия, находим:
![]() Дж.
Дж.
Работа расширения газа при постоянном давлении выражается формулой:
![]() .
.
Подставив числовые значения, получим:
![]() Дж.
Дж.
Работа газа,
нагреваемого при постоянном объеме,
равна нулю, т.е.
![]() .
Следовательно, полная работа, совершенная
газом, равна:
.
Следовательно, полная работа, совершенная
газом, равна:
![]() Дж.
Дж.
Согласно первому
началу термодинамики теплота
![]() ,
переданная газу, равна сумме изменения
внутренней энергии
,
переданная газу, равна сумме изменения
внутренней энергии![]() и работы
и работы![]() :
:
![]() ,
,
следовательно,
![]() Дж
= 3,64 МДж.
Дж
= 3,64 МДж.
График процесса приведен на рис. 2.1.
О т в е т:
![]() Дж,
Дж,![]() Дж,
Дж,![]() МДж.
МДж.
Задача 2.5
В цилиндре под поршнем находится водород
массой
![]() кг
при температуре
кг
при температуре![]() К.
Водород сначала расширился адиабатически,
увеличив свой объем в
К.
Водород сначала расширился адиабатически,
увеличив свой объем в![]() раз,
а затем был сжат изотермически, причем
объем газа уменьшился в
раз,
а затем был сжат изотермически, причем
объем газа уменьшился в![]() раз.
Найти температуру в конце адиабатического
расширения и работу, совершенную газом
при этих процессах. Изобразить процесс
графически.
раз.
Найти температуру в конце адиабатического
расширения и работу, совершенную газом
при этих процессах. Изобразить процесс
графически.
|
Д а н о: С И
|
Р е ш е н и е |
|
|
Температуры и объемы газа, совершающего адиабатический процесс, связаны между собой соотношением:
где
|
|
|
Из соотношения (1) имеем:
![]() .
.
Подставляя числовые значения заданных величин, находим
![]() К.
К.
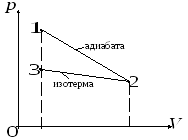
Рис. 2.2
Работу
![]() газа при адиабатическом процессе найдем
из первого начала термодинамики:
газа при адиабатическом процессе найдем
из первого начала термодинамики:
![]() ,
(2)
,
(2)
так как процесс протекает без теплообмена с окружающей средой.
Из (2) следует, что
![]() .
(3)
.
(3)
Проверим единицу размерности искомой величины:
![]() Дж.
Дж.
Подставив в (3) числовые значения, получим:
![]() Дж.
Дж.
Работа
![]() газа при изотермическом процессе может
быть выражена в виде:
газа при изотермическом процессе может
быть выражена в виде:
![]() или
или
![]() ,
,
где
![]() .
.
Подставляя известные числовые значения величин, входящих в правую часть этого равенства, и выполняя арифметические действия, находим
![]() Дж.
Дж.
Знак «минус» показывает, что при сжатии газа работа совершается над газом внешними силами. График процесса приведен на рис. 2.2.
О т в е т:
![]() К,
К,![]() Дж,
Дж,![]() Дж.
Дж.

 или
или