
Archive / Конспект лекций от 02.04.12 - копия / УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА 3
.docx
ИЗОПРОЦЕССЫ.
УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА.
1.Изопроцессы. Графики изопроцессов.
а) Изотермический процесс.

Закон Бойля-Мариотта.
При постоянной массе газа и неизменной температуре произведение давления газа на его объём есть величина постоянная.
PV=const
или
P1V1=P2V2
или
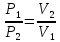
б) Изобарный процесс.

Закон Гей-Люссака.
С введением абсолютной термодинамической шкалы запись этого закона упрощается.
При постоянной массе газа и неизменном давлении отношение объёма газа к его температуре постоянно.

в) Изохорный процесс.

Закон Шарля.
С введением абсолютной термодинамической шкалы запись этого закона упрощается.
При постоянной массе газа и неизменном объёме отношение давления газа к его температуре постоянно.
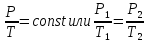
2.Уравнение состояния идеального газа или уравнение Клапейрона.
Покажем, что для
двух состояний одной и той же массы газа
можно записать:
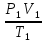 =
=
Переведём газ из состояния P1 V1 T1 в состояние P2 V2 T2 через промежуточное состояние P3 V3 T3.
Нагреем газ изобарно
(переход 1-3). Для этого процесса можно
записать:
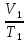 =
=
Так как Р1=Р3,
то умножим левую часть равенства на Р1,
а правую на Р3.
 =
=

Сожмём газ изотермически (переход 3-2).
Так как P3V3=P2V2, а Т3=Т2, то P3V3 заменим на P2V2, а Т3 на Т2. Получим:
 =
= или
или
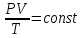
Это уравнение состояния идеального газа или уравнение Клапейрона.
При любом изменении состояния данного количества газа произведение давления на объём, делённое на абсолютную температуру, остаётся постоянным.
3.Уравнение Клапейрона-Менделеева.
Если газ находится под давлением Р0 = 1 атм. = 1,013 105 Па = 760 мм рт.ст. и при температуре Т0 =273 К ( t0 = 00C), то говорят, что газ находится при нормальных условиях (н.у.).
По закону Авогадро 1 моль газа при н.у. занимает объём V0 = 22,4 л = =22, 4 10-3 м-3. Тогда для одного моля

На основании уравнения Клапейрона, можно утверждать, что для любого состояния одного моля идеального газа верно равенство
 , где R=8,31
, где R=8,31 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Следовательно PV = RT.
Д.И.Менделеев показал, что для ν молей
PV
= νRT
или

Это уравнение Клапейрона-Менделеева.
4.Температура – мера средней кинетической энергии движения молекул.
Уравнение Клапейрона-Менделеева позволяет получить ещё одну (четвёртую) формулировку основного уравнения МКТ.
Для этого, используя уравнение Клапейрона-Менделеева выразим давление
 =
=
 =
=
 = nkT,
= nkT,
где
 = 1,38 10-23 Дж/К
– постоянная Больцмана.
= 1,38 10-23 Дж/К
– постоянная Больцмана.
Итак,
 – четвёртая
формулировка основного уравнения МКТ.
– четвёртая
формулировка основного уравнения МКТ.
Сравним это
выражение со второй формулировкой
 .
Тогда
.
Тогда
 и
и
 =
=
 kT
или
kT
или

Отсюда видно, что температура – это величина, которая характеризует среднюю кинетическую энергию поступательного движения молекул идеального газа.
Последние выражения позволяют установить зависимость между среднеквадратичной скоростью поступательного движения молекул газа и его температурой.
По определению
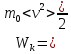 , где
, где
 – масса одной
молекулы. Следовательно,
– масса одной
молекулы. Следовательно,
 =
=
 kT
и
kT
и
 =
=
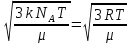
5.Закон Дальтона.
Если в сосуде имеется смесь из двух или более химически не взаимодействующих газов, то давление смеси равно сумме парциальных давлений этих газов.
Парциальным называется давление, которое оказывал бы газ на стенки сосуда, если бы находился в этом сосуде один.
Допустим, что смесь состоит из n газов. Тогда давление смеси
 +…+
+…+
Где Р1, Р2 … Рn – парциальные давления газов.
