
Archive / Конспект лекций от 02.04.12 - копия / ТЕМПЕРАТУРА И ЕЁ ИЗМЕРЕНИЕ 2
.docx
ТЕМПЕРАТУРА И ЕЁ ИЗМЕРЕНИЕ.
ЭКСПЕРИМЕНТАЛЬНЫЕ ГАЗОВЫЕ ЗАКОНЫ.
1.Тепловое равновесие. Температура.
Температура – это физическая величина, характеризующая степень нагретости тела. Если два тела разной температуры привести в соприкосновение, то, как показывает опыт, более нагретое тело будет охлаждаться, а менее нагретое – нагреваться, т.е. происходит теплообмен – передача энергии от более нагретого тела к менее нагретому без совершения работы.
Энергия, передаваемая при теплообмене, называется количеством теплоты.
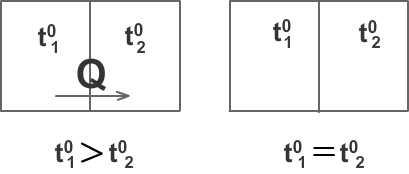
Через некоторое время после приведения тел в соприкосновение они приобретают одинаковую степень нагретости, т.е. приходят в состояние теплового равновесия.
Тепловое равновесие – это такое состояние системы тел, находящихся в тепловом контакте, при котором теплообмен не происходит и все макропараметры тел остаются неизменными, если внешние условия не меняются.
При этом два параметра – объём и давление – могут быть различными для разных тел системы, а третий, температура, в случае теплового равновесия одинаков для всех тел системы. На этом основано определение температуры.
Физический параметр, одинаковый для всех тел системы, находящихся в состоянии теплового равновесия, называется температурой этой системы.
Например, система состоит из двух сосудов с газом. Приведём их в соприкосновение. Объём и давление газа в них могут быть различными, а температура в результате теплообмена станет одинаковой.
2.Измерение температуры.
Для измерения температуры используют физические приборы – термометры, в которых о величине температуры судят по изменению какого-либо параметра.
Для создания термометра необходимо:
-
Выбрать термометрическое вещество, параметры (характеристики) которого изменяются при изменении температуры (например, ртуть, спирт и т.д.);
-
Выбрать термометрическую величину, т.е. величину, которая изменяется с изменением температуры (например, высота ртутного или спиртового столбика, величина электрического сопротивления и т.д.);
-
Откалибровать термометр, т.е. создать шкалу, по которой будет производиться отсчёт температуры. Для этого термометрическое тело приводится в тепловой контакт с телами, температуры которых постоянны. Например, при построении шкалы Цельсия температура смеси воды и льда в состоянии плавления принимается за 00С, а температура смеси водяного пара и воды в состоянии кипения при давлении 1 атм. – за 1000С. Отмечается положение столбика жидкости в обоих случаях, а затем расстояние между полученными метками делится на 100 делений.
При измерении температуры термометр приводят в тепловой контакт с телом, температура которого измеряется, и после того, как установится тепловое равновесие (показания термометра перестанут меняться), считывается показание термометра.
3.Экспериментальные газовые законы.
Параметры, описывающие состояние системы, взаимозависимы. Установить зависимость друг от друга сразу трёх параметров сложно, поэтому немного упростим задачу. Рассмотрим процессы, при которых
а) количество вещества (или масса) постоянно, т.е. ν=const (m=const);
б) значение одного из параметров фиксировано, т.е. постоянно либо давление, либо объём, либо температура.
Такие процессы называются изопроцессами.
1).Изотермический процесс, т.е. процесс, происходящий с одним и тем же количеством вещества при постоянной температуре.
Исследован Бойлем (1662 г.) и Мариоттом (1676 г.).
Упрощённая схема опытов такова. Рассмотрим сосуд с газом, закрытый подвижным поршнем, на который устанавливаются грузики, уравновешивающие давление газа.
Опыт
показал, что произведение давления на
объём газа при постоянной температуре
есть величина постоянная. Это значит

PV=const
Закон Бойля-Мариотта.
Объём
V
данного количества газа ν при постоянной
температуре t0
обратно пропорционален его давлению,
т.е.
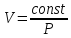 .
.
Графики изотермических процессов.
График
зависимости давления от объёма при
постоянной температуре называется
изотермой. Чем больше температура, тем
выше на графике располагается изотерма.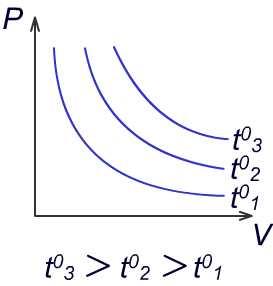
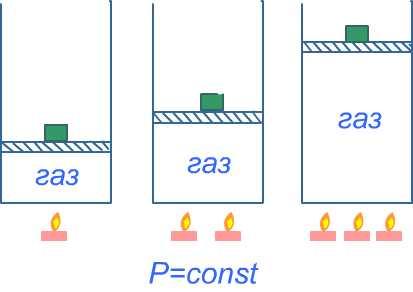
2).Изобарный процесс, т.е. процесс, происходящий с одним и тем же количеством вещества при постоянном давлении.
Исследован Гей-Люссаком (1802 г.).
Упрощённая схема такова. Сосуд с газом закрыт подвижным поршнем, на котором установлен грузик, уравновешивающий давление газа. Сосуд с газом нагревается.
Опыт
показал, что при нагревании газа при
постоянном давлении его объём изменяется
по следующему закону:
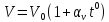 где
V0
– объём газа при температуре t0
= 00C;
V
– объём газа при температуре t0,
αv
– температурный коэффициент объёмного
расширения,
где
V0
– объём газа при температуре t0
= 00C;
V
– объём газа при температуре t0,
αv
– температурный коэффициент объёмного
расширения,
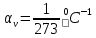
Закон Гей-Люссака.
Объём данного количества газа при постоянном давлении линейно зависит от температуры.
Графики изобарных процессов.
График
зависимости объёма газа от температуры
при постоянном давлении называется
изобарой.
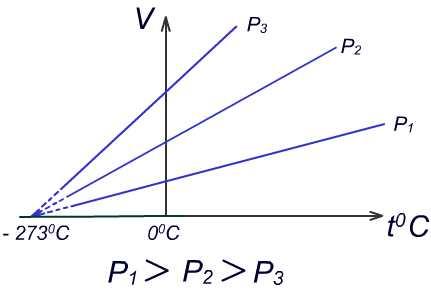
Если экстраполировать (продолжить) изобары в область низких температур, то все они сойдутся в точке, соответствующей температуре t0= - 2730С.
3).Изохорный процесс, т.е. процесс, происходящий с одним и тем же количеством вещества при постоянном объёме.
Исследован Шарлем (1802 г.).
Упрощённая схема такова. Сосуд с газом закрыт подвижным поршнем, на который устанавливаются грузики, уравновешивающие давление газа. Сосуд нагревается.
Опыт
показал, что при нагревании газа при
постоянном объёме его давление изменяется
по следующему закону:
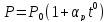 где
P0
– объём газа при температуре t0
= 00C;
P
– объём газа при температуре t0,
αp
– температурный коэффициент давления,
где
P0
– объём газа при температуре t0
= 00C;
P
– объём газа при температуре t0,
αp
– температурный коэффициент давления,
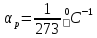
Закон Шарля.
Давление данного количества газа при постоянном объёме линейно зависит от температуры.
График
зависимости давления газа от температуры
при постоянном объёме называется
изохорой.
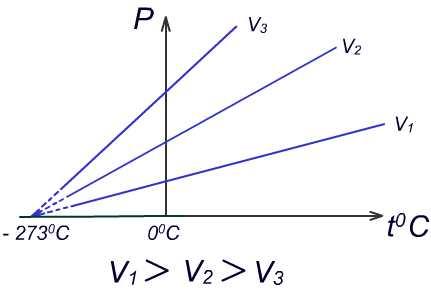
Если экстраполировать (продолжить) изохоры в область низких температур, то все они сойдутся в точке, соответствующей температуре t0= - 2730С.
4.Абсолютная термодинамическая шкала.
Английский учёный Кельвин предложил переместить начало температурной шкалы влево на 2730 и назвать эту точку абсолютным нулём температуры. Масштаб новой шкалы такой же, как и у шкалы Цельсия. Новая шкала называется шкалой Кельвина или абсолютной термодинамической шкалой. Единица измерения – кельвин.
Нулю градусов Цельсия соответствует 273 К. Температура по шкале Кельвина обозначается буквой Т.
T = t0C + 273
t0C = T – 273
Новая шкала оказалась более удобной для записи газовых законов.
